대구한의대학교 화장품공학부 김완일·이경하 교수팀


[더케이뷰티사이언스] 대구한의대학교 화장품공학부 화장품공학전공 김완일·이경하 교수팀이 (재)경북산학융합본부 주관의 ‘2018 Pride Brain 21 사업’ 수행으로 ㈜바이나리와 공동연구를 통해 기업에서 요구하는 저산소 세포배양 방법론을 개발하여 기술이전 하였다.
최근의 다양한 연구에 따르면 저농도(低濃度)의 산소(酸素) 배양은 생체의 다양한 반응의 변화를 유발한다. 예를 들면, 2% 산소환경에서의 세포 배양은 폐의 상피세포(Human Bronchial Epithelial Cell)의 모양을 좀 더 생체와 가까운 구형으로 변화 시켰으며, 또한 종양형성의 주요 유전자인 Kras의 발현을 변화시켰다(Schafer, Mohan et al. 2016). 이러한 변화는 대상 세포를 좀 더 실제 생체에 가까운 환경에 처하게 한 것으로, 관련된 생물학적 반응의 연구나 제약 산업 등의 적용에 큰 도움이 될 전망이다. 실제로 저농도 산소배양은 근육세포의 노화에 따른 위축증(안면견갑상완근위축증- Facioscapulohumeral muscular dystrophy)을 연구하는 데 있어서 좀 더 생체와 가까운 환경을 조성하였다(Stadler, Rahimov et al. 2013). 저농도 산소에서의 세포 배양은 또한 줄기세포의 특성에도 커다란 변화를 일으켰는데, 이는 세포내의 산소대사와 관련이 있으며 기존의 배양법보다 훨씬 더 생체에 가까운 모습을 보여 주었다(Lavrentieva, Majore et al. 2010). 이러한 사실들은 기존의 21% 산소농도에서 행해지던 세포 배양은 인체의 세포 내에서 일어나는 현상을 그대로 재연하지 못함을 의미하며, 결국 그러한 방식으로 얻어진 결과들을 실제로 적용하는 데에는 한계가 있음을 의미한다.
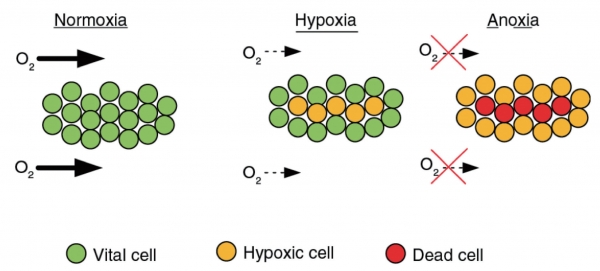
실제 생체 내에서의 산소 농도는 1% ~ 6% 정도이다(Guyton 1966). 따라서 저농도의 산소 환경에서 세포의 반응을 분석하고, 그에 따른 후속 연구개발을 지속하는 것이 타당하다 (그림 1). 국내에서도 서울대학교 의과대학 박종완 교수 등의 연구진에 의해 저산소증 연구가 활발히 진행되고 있으며, 종양·중추신경 등의 분야에서 그 중요성이 서서히 입증되고 있다.
대부분의 동물세포는 대기산소 농도(Normoxia, ~21%)에서 배양된다. 이 조건은 세포의 성장을 촉진하며 실험하기에 편리하다는 장점이 있지만, 생체의 환경과는 괴리가 있으므로 결과의 신뢰성이 낮다. 하지만 저산소(Hypoxia, ~2%)를 적용한 배양은 생체환경과 매우 닮아있으며, 기존의 연구결과와 완전히 다른 세포의 반응을 보인다. 무산소(Anoxia, ~0%) 배양과는 차이가 있으므로 주의를 요한다.
본 연구팀이 개발한 기술은 저농도의 산소환경에서 피부세포·스페로이드(Spheroid)의 반응을 분석하고 저농도 산소에서 적합한 피부세포·스페로이드 배양용 밀폐용기를 제작하는 것이다. 또한 이를 활용한 피부세포·스페로이드의 배양방법론을 확립하는 것을 포함한다.
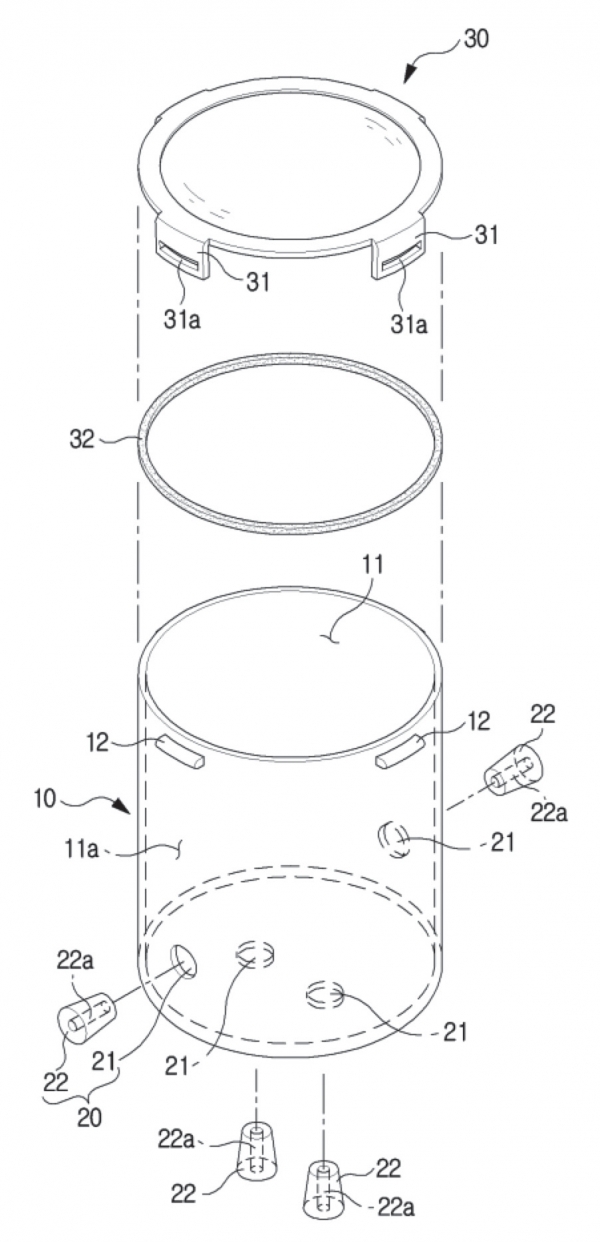
이를 위해 고안된 피부세포 배양용 밀폐용기는 개구부가 형성되고, 내부에 배양공간이 마련되는 본체; 상기 본체에 내부 배양공간으로 관통 형성되는 적어도 하나 이상의 통공과, 상기 통공에 결합되는 고무마개가 구비되는 유입부 및 외주면 가장자리를 따라 상기 본체에 체결되는 걸림쇠가 마련되고, 상기 개구부에 결합되는 캡을 포함한다. 또한, 캡은 내부 가장자리를 따라 상기 개구부의 끝단에 밀착되는 실링패커가 구비되며, 고무마개는 길이방향으로 관통하여 유로가 형성된다. 이후 고무마개는 통공에 결합되어 유로를 밀폐한다.
본 방법론은 2% 산소, 5% 이산화탄소 및 93% 질소가 혼합된 기체를 사용하는 것을 특징으로 한다. 상기 밀폐용기는 배양공간의 산소 농도가 2.5%에 도달하면 구비된 고무마개의 탄성으로 유로를 폐쇄시키는 것이 특징이다.
이러한 방법을 통해 다양한 분야의 연구자들은 값비싼 저농도 산소 배양기를 구매할 필요 없이 저렴하게 피부세포·스페로이드 배양을 이룰 수 있으며, 향상된 밀폐능을 통해 배양 중 잦은 가스의 이탈을 방지할 수 있다. 또한, 이에 따른 배양 방법을 통해 고수율의 피부세포·스페로이드를 획득할 수 있다.
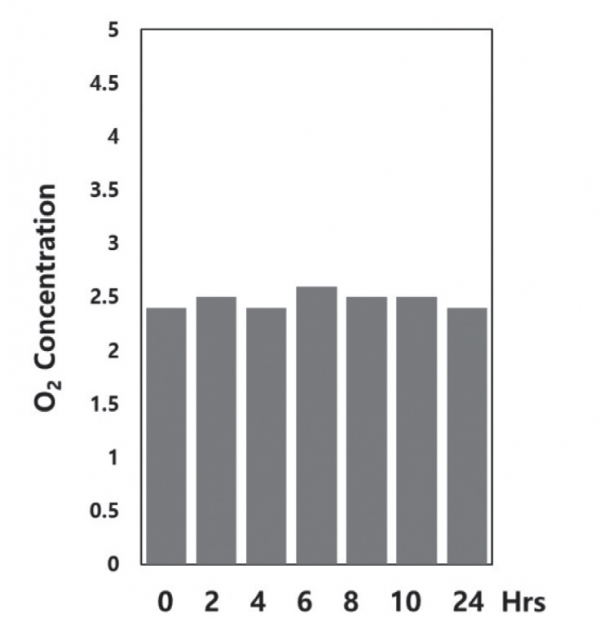
밀폐 용기의 산소 농도는 휴대용 디지털 산소농도 감지기(KXL-803)를 이용하여 매시간 간격을 두고 측정하였으며, 측정된 산소농도는 그림 3에 나타내었다. 이를 참조하면 밀폐 용기 내부의 산소 농도는 24시간 이상 2.5%에서 일정하게 유지되었다.
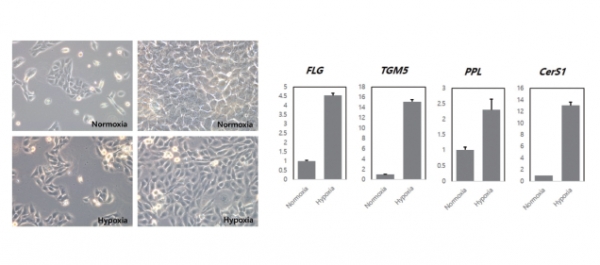
인간 피부세포/각질세포주의 일종인 HaCaT세포는 DMEM(Dulbecco′s Modified Eagle′s Medium), 10% FBS(Fetal Bovine Serum), 1% Penicillin/Streptomycin을 배합한 배지에서 배양되었다. 5% CO²를 지속적으로 공급하는 37℃ 배양기 내에서 유지되었으며, 저농도 산소(2.5%)를 주입하여 24시간 배양하였다. 그 결과, 21%의 산소(Normoxia)에서 배양된 각질세포와 2.5%의 산소(Hypoxia)에서 배양된 각질세포는 외형상의 차이가 거의 없음을 확인하였다(그림 4).
또한 수집된 세포에서 RNA를 정제한 후 cDNA를 합성하였으며, 이를 활용하여 유전자 정량분석을 수행하였다(그림 4). 이때 실시간 중합효소연쇄반응(Real-time polymerase chain reaction, real-time PCR, quantitative real time polymerase chain reaction, qPCR)을 활용하였는데, 이는 중합효소 연쇄 반응을 기반으로 하는 실험방법이다. 실시간 중합효소연쇄반응은 목표 DNA분자의 증폭과 양의 측정을 동시에 수행하며, DNA샘플에서 하나 또는 그 이상의 특정 서열 검출과 양의 측정을 할 수 있게 한다. 계량은 상대적인 양을 고려하였다. 실험의 진행은 일반적인 중합효소연쇄반응을 따랐다. 중요한 특징은, 증폭된 DNA가 실시간으로 측정된다는 것이며, 이 점이 마지막에서 DNA가 관측이 되는 기본적인 중합효소연쇄반응과의 차이이다.
그 결과, 천연보습인자(NMF; Natural Moisturizing Factor) 생성에 중요한 역할을 담당하는 FLG, TGM5, PPL 등의 유전자 발현이 저산소 환경에서 매우 증가하는 양상을 보였다. 이는 저농도 산소 환경에서 각질세포의 분화능력이 증가하였음을 의미하며, 다양한 소재 개발 및 피부세포의 분석에 있어서 저산소 배양이 필요함을 의미한다. 저산소 환경에서의 세포배양이 피부세포의 특징을 더욱더 생체와 가까운 방향으로 변화시키며, 따라서 분석 및 소재 탐색 등에 더욱 적합한 모델임을 확인하였다. CerS1은 각질층을 구성하는 주요 지질인 세라마이드(Ceramide)를 합성하는 데 핵심적인 유전자이며, 저농도 산소 환경에서 10배 이상 발현이 증가하는 양상을 보였다. 따라서 화장품 소재 탐색 및 관련 실험을 고려함에 있어서 저산소 환경을 유지하는 것이 매우 중요함을 확인하였다. 저산소 환경 조성을 통해 더욱 적합한 모델을 구축할 수 있고 추가적인 자원의 소모를 줄일 수 있다. 특히 본 기술에서 제시하는 저농도 산소 배양용기는 매우 저렴한 가격으로 장기간 저산소 환경을 구축할 수 있는 장점이 있다.
특허정보
[10-2018-0132386] 세포 배양용 밀폐용기 및 이를 이용한 세포 스페로이드 배양 방법, 대구한의대학교 산학협력단
[10-2018-0132387] 세포 배양용 밀폐용기 및 이를 이용한 피부세포 배양 방법, 대구한의대학교 산학협력단
REFERENCES
1. Guyton, A. C. H., E. (1966). in Textbook of Medical Physiology Transport of oxygen and carbon dioxide in the blood and bodily fluids.
2. Lavrentieva, A., I. Majore, C. Kasper and R. Hass (2010). "Effects of hypoxic culture conditions on umbilical cord-derived human mesenchymal stem cells." Cell Commun Signal 8: 18.
3. Schafer, C., A. Mohan, W. Burford, M. K. Driscoll, A. T. Ludlow, W. E. Wright, J. W. Shay and G. Danuser (2016). "Differential KrasV12 protein levels control a switch regulating lung cancer cell morphology and motility." Converg Sci Phys Oncol 2(3): 035004.
4. Sonntag, F., Busek M, Grunzner S, Steege T, and Klotzbach U (2016). “Hypoxia-on-a-chip” Cur. Direct. in Biomed. Eng. 2(1): 71-75
5. Stadler, G., F. Rahimov, O. D. King, J. C. Chen, J. D. Robin, K. R. Wagner, J. W. Shay, C. P. Emerson, Jr. and W. E. Wright (2013). "Telomere position effect regulates DUX4 in human facioscapulohumeral muscular dystrophy." Nat Struct Mol Biol 20(6): 671-678.
6. Wright, W. E. and J. W. Shay (2000). "Telomere dynamics in cancer progression and prevention: fundamental differences in human and mouse telomere biology." Nat Med 6(8): 849-851.
7. Wright, W. E. and J. W. Shay (2006). "Inexpensive low-oxygen incubators." Nat Protoc 1(4): 2088-2090.