IFSCC 2022 London Congress 〈4〉 ⑤ 대한민국 포스터 발표 논문 - H&A파마켐

엑소좀Exosome은 단백질, 지질, RNA 및 DNA의 특정 구성을 포함하는 세포외 소포이다. 세포외 소포에서 파생되며 수용 세포에 신호를 전달할 수 있으므로 세포 간 통신의 새로운 메커니즘을 매개한다. 리포좀Liposome은 콜레스테롤과 인지질로부터 생성될 수 있는 구형의 작은 인공 소포이다. 엑소좀과 리포좀은 하나의 지질 이중층으로 구성된 나노베지클이라는 점에서 유사점이 많다. 이 연구의 목적은 생체 활성 화합물의 치료 전달을 위해 자연적으로 발생하는 엑소좀과 이질성과 낮은 생산성의 한계를 극복하는 인지질의 독특한 혼합물을 가진 새로운 유형의 리포좀을 개발하는 것이다. 이러한 결과는 합성된 하이브리드 베시클을 화장품에 적용시키기 위한 흥미로운 플랫폼이 될 것임을 시사한다.
배경
엑소좀은 직경 50~150nm의 세포 유래 막 소포로 혈액, 타액, 기타 세포외액, 세포배양액에서 쉽게 찾을 수 있다. 생체적합성, 비면역성, 장기 순환, 무독성 등이 장점이다[1]. 이 나노입자는 생체 활성 지질과 수송 단백질을 포함하고 있으며 구조에는 마이크로 RNA가 포함되어 있다. 그들은 손상되거나 병든 세포를 복구하기 위해 수용 세포에 생물학적 신호를 전달하는 세포 사이의 메신저 역할을 한다. 즉, 세포간 소통을 매개하고 면역반응을 조절하는 중요한 역할을 한다. 최근 식물 유래 엑소좀의 다양한 효능에 대한 연구가 진행되고 있으며, 항산화, 항염증 등의 피부 효능에 대한 연구도 본격화되고 있다. 식물 유래 엑소좀은 식물 세포에서 분비되는 생리활성과 신호 전달 물질을 함유하고 있어 세포의 이동과 흡수를 돕는 천연 나노입자이며, 포유류 유래 엑소좀보다 독성이 낮은 것으로 알려져 있다[2]. 그러나 캡슐화가 까다로워 기존 약물 전달 시스템의 낮은 전달률 및 생합성과 같은 약물 전달 응용에 한계가 있다.
리포좀은 단일 또는 다중 이중층 막을 형성하기 위해 양친매성 인지질로 구성된 나노 크기의 지질 소포이다[3]. 리포좀은 효율적인 약물 부하, 확장성, 조정 가능한 크기 및 쉽게 제어할 수 있는 표면 기능화, 치료 관련성에 대한 강력한 전임상 및 임상 증거를 포함하여 약물 전달에 유리한 특징을 가지고 있다[4]. 그러나 대부분의 나노입자 유형과 마찬가지로 리포좀은 면역 체계에 의해 쉽게 인식되며 표적 세포로 거의 내부화되지 않는다. 가장 가능성 있는 약물 전달체 중 하나이지만 빠른 약물 누출과 불완전한 약물 방출 등의 문제가 있어 이를 개선하기 위한 추가 연구가 필요하다. 이번 엑소좀-리포좀 하이브리드 제형 연구의 목적은 엑소좀과 리포좀의 장점을 모두 취하면서 각각의 단점을 극복하는 것이다.
내용 및 방법
1. 세포 배양
센텔라 아시아티카Cica 세포는 제노헬릭스 연구소Incheon, Republic of Korea로부터 제공받았다.
2. 엑소좀 준비
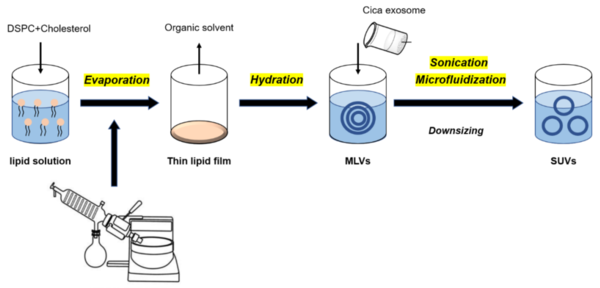
전처리된 Cica 샘플 100μl를 준비하고 Extracellular Vesicle lsolationEVI Pre-buffer 50μl와 혼합한다. 4°C에서 30분 동안 14,000xg에서 혼합물을 원심분리하여 상층액을 새 튜브로 옮긴다. 여기에 XENO-EVI buffer 40μl를 추가하고 볼텍싱하여 샘플을 혼합한다. 혼합물을 상온(15~25°C) 에서 10분 동안 배양하고 12,300xg에서 10분 동안 원심분리하여 상층액을 버린다. 다음으로 튜브를 12,300xg에서 15초 동안 원심분리하고 남은 상층액을 버린다. 1XPBSprotein and other analysis 또는 EVARI bufferEV RNA purification의 ≥ 50μl에서 펠릿을 포함하는 EV를 완전히 재현탁한다. 그런 다음 엑소좀 펠릿을 phosphate buffer salinePBS 또는 DMEM에 재현탁하고 -20°C에서 보관하였다.
3. 리포좀 준비
박막 수화 기술은 일반적으로 리포좀을 준비하는데 사용된다. 일부에서는 ‘Hand Shaking Method’라고도 한다[5]. 이 방법으로 리포좀을 제조하기 위해 둥근 바닥 플라스크에 유기 용매를 취하고 여기에 Lipoid S 75-3Lipoid GmbH, Ludwigshafen, Germany과 PhospholipidsDSPC을 함께 첨가한다. 이후, 유기 용매는 회전식 진공 증발기에서 증발되며 증발 시 둥근 바닥 플라스크의 내부 표면에 얇은 층이 형성된다. 잔류 미량 용매를 진공에서 완전히 제거하여 유리 플라스크의 벽에 박막을 생성하였다.
4. 엑소좀-리포좀 하이브리드 합성
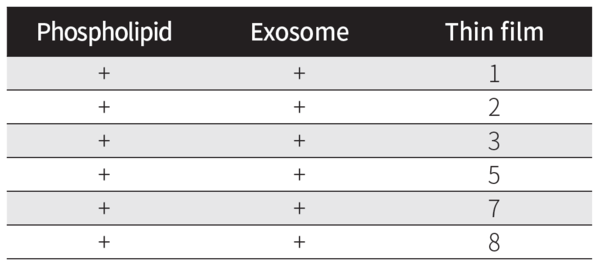
이전에 분리된 Cica 엑소좀을 사용하여 건조 지질층을 수화하였다. 수화되면 층이 부풀어 오르고 약물을 포함하는 다층 소포가 형성된다[6]. 동일한 함량으로 첨가된 인지질 및 엑소좀을 (표 1)에 나타낸 바와 같이 최종 부피 1mL로 지질 필름에 첨가하였다. 그런 다음 적절한 혼합을 위해 와동 및 초음파 처리(30% amplitude, 30 sec pulse on/off, for 30min) 를 하였다. 이렇게 형성된 다층 하이브리드 용액을 Microfluidizer를 사용하여 입자 크기를 줄이기 위해 두 번 통과시켰다.
결과 및 고찰
리포좀 대 Cica 엑소좀의 비율은 3:1로 최적화되었다. 엑소좀은 단백질 함량을 기준으로 정량화 한 반면 리포좀은 지질 중량을 기준으로 정량화하였다. 1mL PBS에 분산된 엑소좀의 1000mg 단백질 등가물을 지질막 300mg에 첨가하였다. 이는 microfluidization 후 (표 1)에 나타낸 바와 같이 엑소좀-리포좀 하이브리드의 형성을 초래하는 lipid cake에 대한 지질 필름의 수화를 개시한다.
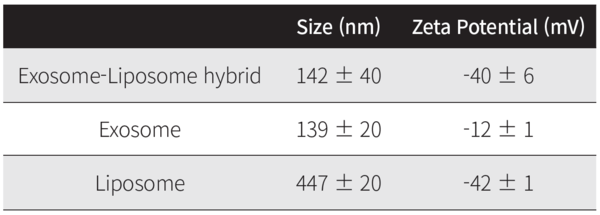
리포좀, 엑소좀 및 하이브리드는 크기, 표면 특성 및 단백질 함량에 대해 특성화되었다. (그림 2)는 이들 나노베지클의 안정성과 함께 유체역학적 크기 분포 및 제타 전위에 대한 비교 연구를 보여준다. 지질 소포의 크기를 줄이기 위해 고압 미세 유화는 하이브리드의 유체역학적 크기에 큰 변화를 주었고 입자 사이즈는 142nm로 나타났다(그림 2).
다운사이징 후 하이브리드의 형태학적 변화를 Cryo-TEMCryo-Transmission Electron Microscopy 으로 분석하였다. TEM 이미지(그림 3)는 소포 구조를 가진 나노입자의 일반적인 분포를 보여준다. 또한, microfluidization을 이용하여 크기를 줄임으로써 안정화된 투명한 액체를 형성하였다(그림 4).


결론
하이브리드 엔지니어링의 목표는 엑소좀과 리포좀 경피 전달 시스템의 장점을 병합하는 것이었다. 식물유래 엑소좀은 천연물로 엑소좀 자체가 이중지질막 구조를 가지고 있기 때문에 피부는 물론 다른 세포에도 흡수가 가능하여 화장품 제제로서 큰 장점이 있다. 이번 실험에서는 센텔라 아시아티카 유래 엑소좀과 합성 리포좀을 융합하여 균일한 크기 분포를 갖는 엑소좀-리포좀 하이브리드를 제형화하였다.