을지대학교 미용화장품과학과 이창석 교수

[더케이뷰티사이언스] 계면활성제(Surfactant)란 우리의 일상생활에서 사용하고 있는 대부분의 생활용품에 포함된 화학물질이다. 친수성(Hydrophilic)인 극성과 소수성(Hydrophobic)인 비극성 부분으로 구성되어 있으며, 극성 부분이 음이온, 양이온, 양성이온(Zwitterion)으로 이루어짐에 따라 계면활성제는 여러 종류로 분류된다. 화장품에서도 기름과 물이 분리되지 않도록 에멀전의 안전한 상태를 유지하려면 계면활성제는 반드시 필요한 존재다. 하지만 대부분의 합성계면활성제의 경우, 피부자극 등 안전성 문제가 대두되어왔다. 이에 최근 천연 혹은 바이오 계면활성제(Biosurfactant)에 대한 니즈가 높아져 왔는데, 바이오 계면활성제인 MEL이 효능 소재로서 응용될 수 있다는 연구가 보고되었다. 자연환경의 효모 균주에서 만들어지는 MEL은 당과 지방산으로 이루어진 계면활성제로 인체에 무해하고 친환경적이다. 피부 약리학을 전공한 이창석 교수는 아모레퍼시픽에서 재직하던 8년간 대부분을 화장품 소재 효능평가 및 기전연구를 해왔으며 MEL의 새로운 효능을 발굴한 주인공이다. 2018년 3월 을지대학교 미용화장품과학과에 새롭게 부임한 이창석 교수를 만나 MEL에 관해 들었다.
MEL 연구를 시작한 계기가 궁금합니다.
MEL(Mannosylerythritol lipids)은 제가 아모레퍼시픽의 연구원으로 있을 때부터 시작된 연구입니다. 저는 소재효능평가를 담당해서 아모레 자체에서 개발하는 원료뿐 만 아니라 외부에서 들어오는 소재들을 평가했는데 그 중 하나가 MEL이었어요. MEL은 일본에서 발견되었고, 우리나라에는 다미화학이 처음 도입해 연구한 소재입니다. 2016년 다미화학이 생명공학연구원과 합작하여 MEL 개발을 위해 디케이바이오를 설립했는데요. 계면활성제는 화장품에 반드시 필요하므로 친환경적인 바이오 계면활성제를 개발하고자 하였고, 대전 과수원에서 토착 효모 균주 일종인 ‘슈도지마 SY16’을 발견한 것입니다. 이를 통해 MEL을 높은 효율로 생산할 수 있었고, 다미화학이 바이오 계면활성제인 MEL의 알려지지 않은 효능에 대해 아모레퍼시픽에 소개한 것이지요. 당시 참고문헌을 찾았을 때는 대부분 계면활성 능력에 대한 보고였으며, 효능에 대해서는 보습, 헤어 리페어, 피부자극 완화기능만 알려져 있었고 그 외에는 연구된 바가 거의 없었습니다. 그래서 아모레퍼시픽에서 스킨케어 부분에서의 항노화, 미백, 항염 순으로 효능연구를 시작하게 된 것이지요.
발표하신 연구 내용에 대해 소개해주세요.
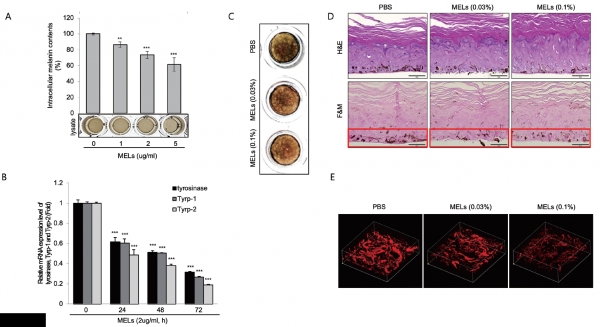
우선 MEL 관련 논문의 90%는 바이오 계면활성제로서의 화학적 공정개선, 구조 분석, 신규타입 발굴 등 케미컬 중심의 연구들로 보고되어 왔습니다. 바이오 효능에 관해서는 보습 및 헤어 리페어 정도만 찾을 수 있었지요. 생물학자(Biologist)로서 MEL 보습효능의 메커니즘 연구와 보습 이외의 새로운 효능을 발굴하자는 두 가지 전략으로 연구를 시작했습니다. 보습은 임상에서만 확인된 결과만 알려져 있었기에 자세한 메커니즘을 규명하고자 한 것입니다. 보습 이외의 효능을 스크리닝한 것은 바로 미백이었는데요, 미백은 저도 깜짝 놀랄 정도로 놀라운 효능 결과를 보였습니다. 계면활성제로서 세포를 죽여 미백을 나타낸 것이 아닐까 의심했는데 세포생존능에는 아무런 영향 없이 멜라닌 합성을 감소시키는 것을 확인했습니다. 이에 미백 효능을 발굴하면서 미백 메커니즘까지 규명하고자 했습니다.
미백효능 메커니즘 규명 과정이 궁금한데요.
미백 메커니즘을 연구할 때 가장 먼저 확인하는 0순위 타깃이 타이로시네이즈(Tyrosinase)인데요, MEL은 전형적인 멜라닌 합성 시그널과 관련이 있었습니다. 다시 말해 가장 보편화된 멜라닌 합성 기전을 억제한다면 가장 보편화된 미백 소재로 사용될 수 있다는 말과도 일맥상통하는 것이지요. 또 미백 확인실험은 보통 B16 세포에서 진행하는데요, 여기서 확인하는 것에 그치면 임상시험까지 진행했을 때 실제 사람에서 상관관계(Correlation)가 떨어질 확률이 높아지게 됩니다. 그래서 다각도로 효능이 확실한지 검증하기 위해 B16 세포에서 확인한 후 NHM(Normal human melanocyte) 및 인공피부까지 MEL 효능을 확인했습니다. 결과로 MEL이 타이로시네이즈, MITF, CREB, ERK까지 모두 차례로 억제하는 것을 확인하면서 MEL의 새로운 미백 메커니즘을 규명했습니다.
기술적인 면에서도 차별점이 있다고 들었습니다.
형광물질을 부착해 항체(Antibody) 실험으로 발현을 확인하는 보편적인 실험과 달리 Multi-photon 이미지 기술을 도입해 인위적인 조건 없이 멜라닌 자체의 파장대를 읽어 인공피부에서 발광 정도를 측정하여 분포량을 확인했다는 차별점이 있습니다
보습 효능은 어떻게 실험을 진행하셨나요?
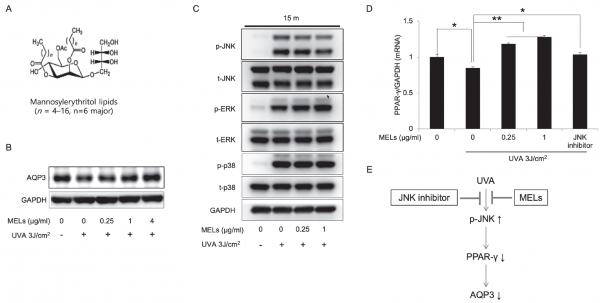
보습의 경우 타깃이 워낙 방대하기 때문에 우선 많이 알려진 단백질을 중심으로 후보군을 찾아야 했습니다. UVA 처리 모델에서 진행한 이유는 자외선에 의한 피부 건성화 모델에서 MEL의 효능을 검증하기 위한 것이었으며, 특히 UVB 뿐만 아니라 실질적으로 UVA가 노화에 영향을 주는 정도가 크고 이로 인해 보습 기능에 주요한 표피의 각질형성세포 (Keratinocyte)에서 MEL의 보습기전을 찾아보고자 하였습니다. 결론적으로, 참고문헌과 예비실험을 통해 UVA 처리 시 아쿠아포린 3가 감소하고 MEL을 처리했을 때 다시 발현양이 올라가는 것을 확인하면서, 이에 대한 메커니즘이 궁금해졌습니다.
아쿠아포린 3를 처음 후보군으로 시작하게 된 과정도 궁금합니다.
아모레퍼시픽의 연구원으로 효능 연구할 당시 보통 보습 효능은 임상으로 수분을 확인하지 않는 이상 세포에서 볼 수 있는 직접적인 방법은 없기 때문에 수분을 머금거나 증발을 억제하는 보습 관여 단백질 후보군을 리스트업 해 놓았습니다. 필라그린(Filaggrin), 인볼루크린(Involucrin), 로리크린(Loricrin)과 같은 NMF(Natural moisturizing factor)와 보습을 위해서는 지질이 튼튼해야하기 때문에 지질합성효소(Fatty acid synthese) 그리고 ABCA12 혹은 아쿠아포린과 같은 채널 단백질이 대표적인 주요 타깃인데요. 특히, 아모레퍼시픽 배일홍 박사님의 아이디어가 중요했습니다. 배 박사님은 아쿠아포린 3가 MEL의 보습효능에 중요한 키 역할을 하지 않을까 하는 가설을 세우고 저와 함께 실험을 디자인하고 진행했습니다.
보습은 어떤 기전을 통해 작용하고 있었나요?
우선 알려진 자외선 메커니즘으로는 MAPK(Mitogen-activated protein kinase)가 주경로인데요, 세 가지 주요 단백질인 JNK, ERK, p38이 UVA 처리 시 활성화되는 것을 모두 확인했습니다. MEL 처리했을 때 JNK만 유독 활성이 억제되는 것을 확인하면서 아쿠아포린 3에도 영향을 미치는지 검증해야했지요. JNK inhibitor 처리한 결과 아쿠아포린 3 발현량이 올라가는 것을 확인하였고, 또 이 사이에 다른 메커니즘이 있지 않을까 하는 궁금증에서 확인했던 것이 PPAR-γ였습니다. 참고 문헌 중 JNK가 활성화되면 PPAR-γ가 감소한다는 연구와 PPAR-γ가 아쿠아포린 3 발현량을 증가시킨다는 보고된 연구결과가 있었습니다. 이를 종합했을 때 자외선에 의해 JNK가 활성화되고, PPAR-γ가 억제되어 아쿠아포린 3가 감소할 수 있다는 결론을 얻을 수 있었고, 실제로 MEL 처리 시 JNK가 억제되고 PPAR-γ의 발현량은 증가하며 아쿠아포린 3 또한 증가하는 것을 확인하면서 최종 보습 메커니즘도 규명할 수 있었습니다.
논문에 항염증 효능에 관한 내용도 있던데, 새로운 연구내용이신가요?
네, 중요한 점을 짚어주셨는데요. 보습메커니즘 규명 과정을 통해 PPAR-γ의 발현량을 확인했는데 사실 PPAR-γ는 항암, 항산화, 항염 및 대사조절 등으로 잘 알려진 핵 수용체(Nuclear receptor)입니다. MEL은 항염 쪽에서는 비만세포(Mast cell)에서 알레르기를 억제한다는 연구결과가 있었습니다. 그래서 피부약리 관점에서 자외선에 의한 염증환경에서 MEL이 항염 효과가 있는지 확인해보려고 합니다. 더불어 지질 강화 분야로 효능 연구를 확대할 예정입니다.
이번 연구 결과로 기대되는 바가 있다면.
이미 원가 절감이 되어있는 MEL의 비용을 더 많이 줄일 수 있다는 점입니다. 우리나라 토착 효모 균주에서 추출했다는 의미도 크지요. 합성 물질이 아니기 때문에 효모군만 대량으로 키우면 원료 수율이 높아지게 되고 이에 따른 원가 절감 효과가 커지게 되는 것인데요. 현재는 관련 업체에서 효모군을 배양해 당, 효소를 이용해서 어떻게 하면 더 많은 원료를 확보할 수 있을지 수율을 높이는 연구를 하고 있는 것으로 알고 있습니다. 그렇게 되면, MEL을 원료로 화장품을 제조 판매하는 업체들도 부담이 줄어 들어 제품 연구 및 판매활성화에도 도움이 될 것이라고 생각합니다. 두 번째로는 더 중요한 부분인데요, 바로 안전성입니다. 수십 가지의 화장품 원료 중 계면활성제는 불가피하게 첨가해야하는 성분 중의 하나입니다. 그렇지만 화장품에 원료가 많이 들어갈수록 피부 자극도 심해지고 안전성도 위협을 받게 되는데요. 이에 따라 최대한 원료 수를 줄이면서 안전성을 확보하는 것이 중요한 전략이 되는 것입니다. 다시 말하면, 원료 수를 줄이려면 원료 하나가 다양한 기능을 해야 합니다. 그런데 효능 성분이 여러 효능을 갖는 경우는 많지만 제형 성분이 효능을 갖는 경우는 흔치 않습니다. 역으로 말하면 제형 성분이 효능까지 가지면 무분별한 효능 성분 첨가를 지양하고 필요한 콘셉트 원료만 넣으면 되는 것이지요.
결론적으로 MEL은 효능을 가진 계면활성제로서 여러 기능을 하는 것이네요.
그렇습니다. 보통 우리가 말하는 이중기능성은 노화나 미백 등의 피부활성 효능을 같이 가지고 있는 것을 말하는데, MEL은 계면활성제와 피부활성 효능 등 이중기능성을 갖는 것이지요. 이는 화장품 제조의 큰 허들을 넘을 수 있는 계기가 될 수 있을 것입니다. 현재 아모레퍼시픽에서는 소개받은 MEL에 관한 자체 심화 연구를 통해 원료 발주 및 제품 생산과정에 있기 때문에 곧 MEL이 들어간 신제품을 소비자가 만날 수 있을 것입니다.

오랜 기간 효능연구를 해오시면서 기억에 남는 에피소드가 있나요?
아모레퍼시픽에 근무할 당시 8년간 연구해서 작년에 출시된 ‘에스트라 화이트736 톤업 브라이터’에 관한 이야기인데요. 미백 연구를 진행하면서 저희가 개발한 AP736™이 함유된 제품화를 본격 추진할 즈음, 2013년 일본 가네보에서 개발한 로도데놀(4HPB)로 인한 백반증 부작용으로 리콜사태가 벌어진 적이 있습니다. 대부분의 환자가 제품을 쓰고 2~3년 후 발병하였고, 이로 인해 많은 화장품 업체들이 미백소재 개발에 소극적으로 돌아섰습니다. 아모레퍼시픽에서도 안전성에 대한 우려 때문에 부작용이 나지 않을 확실한 근거가 없다면 제품을 출시할 수 없다며 프로젝트가 중단될 위기에 처했었지요.
저희 프로젝트 멤버들은 어떻게 안전성을 입증해야하나 고민 끝에 환자가 많이 생기는 환경을 세포 모델로 대입해서 실험을 진행했습니다. 당시 문제가 됐던 로도데놀을 포함한 백반증을 일으키는 원료들과 시장에서 안전성이 입증된 원료들의 비교실험을 진행했는데, 로도데놀은 양이 많아질수록, 오래 반응시킬수록, 자외선이 있는 조건일수록 세포독성이 급속히 증가하는 양상을 보였습니다. 반면 안전성이 입증된 원료들과 저희가 개발한 AP736™은 같은 조건 내에서 모두 세포독성을 보이지 않았습니다. 이 외에도 많은 세포 및 임상 실험을 통해 효능과 안전성을 입증함으로써 이후 AP736™은 미백 기능성원료 및 보건복지부신기술(NET) 인증까지 받았습니다. 또한, 미백 원료의 백반증 유발 가능성을 입증할 수 있는 실험방법을 특허 및 논문발표까지 하면서 제품화를 재개할 수 있었습니다. 작년에 피부과전용 미백 화장품으로 출시했는데 반응이 좋다고 들었습니다. 철저한 확인실험을 거듭해 어렵게 제품화되어 나온 만큼 더 많은 소비자들이 믿고 잘 사용하길 바라는 마음이 큽니다.
을지대학교 미용화장품과학과에 대해 소개해주신다면.
4년제 화장품 관련학과로는 수도권에서 을지대학교가 제일 먼저 생긴 것으로 알고 있습니다. 피부 관리과에서 화장품이 융합되면서 명칭이 변경된 것인데요. 현재 화장품분야 3분, 미용분야 3분의 교수님들이 뷰티산업과 피부과학을 다양하게 교육하고 있습니다. 미용과 화장품이 같이 있다 보니 학생들이 뷰티 분야에 대해 넓게 배울 수 있다는 큰 장점이 있습니다.
학생들에게는 진로의 폭이 넓어질 수 있을것 같습니다.
화장품을 공부하러 온 친구가 미용 기술과 트렌드에 대해 이해할 수 있고, 미용 분야를 공부하던 친구가 화장품 분야로 진로를 바꾸는 사례들도 있었어요. 또 을지대학교는 바이오 위주의 이과 중심의 대학교이다 보니 의생명 계열로 특성화된 커리큘럼이 잘 구축되어 있습니다. 특히, 4학년 여름방학에는 모든 학생이 다양한 뷰티업체로 실습을 가서 실제 직장생활을 체험하기도 하고, 4년제 동급 대학중 전국 취업률 1위를 자랑하는 만큼 졸업 후에도 관련 분야에서 두드러진 활동을 하고 있습니다. 종종 기업체에서도 취업 후보자 추천 요청이 들어오고 있고 창업하는 학생도 많이 있습니다. 을지병원, 학교, 기업이 모두 아우를 수 있는 연계 시스템도 잘 되어 있으니 관심이 있는 학생들에게 좋은 교육 환경이 될 것이라고 생각합니다.
Mannosylerythritol lipids ameliorate ultraviolet A-induced aquaporin-3 downregulation by suppressing c-Jun N-terminal kinase phosphorylation in cultured human keratinocytes
ABSTRACT
Mannosylerythritol lipids (MELs) are glycolipids and have several pharmacological efficacies. MELs also show skin-moisturizing efficacy through a yetunknown underlying mechanism. Aquaporin-3 (AQP3) is a membrane protein that contributes to the water homeostasis of the epidermis, and decreased AQP3 expression following ultraviolet (UV)-irradiation of the skin is associated with reduced skin moisture. No previous study has examined whether the skin-moisturizing effect of MELs might act through the modulation of AQP3 expression. Here, we report for the first time that MELs ameliorate the UVA-induced downregulation of AQP3 in cultured human epidermal keratinocytes (HaCaT keratinocytes). Our results revealed that UVA irradiation decreases AQP3 expression at the protein and messenger RNA (mRNA) levels, but that MEL treatment significantly ameliorated these effects. Our mitogenactivated protein kinase inhibitor analysis revealed that phosphorylation of c-Jun N-terminal kinase (JNK), but not extracellular signal-regulated kinase or p38, mediates UVA-induced AQP3 downregulation, and that MEL treatment significantly suppressed the UVA-induced phosphorylation of JNK. To explore a possible mechanism, we tested whether MELs could regulate the expression of peroxidase proliferatoractivated receptor gamma (PPAR- ), which acts as a potent transcription factor for AQP3 expression. Interestingly, UVA irradiation significantly inhibited the mRNA expression of PPAR- in HaCaT keratinocytes, whereas a JNK inhibitor and MELs significantly rescued this effect. Taken together, these findings suggest that MELs ameliorate UVA-induced AQP3 downregulation in HaCaT keratinocytes by suppressing JNK activation to block the decrease of PPAR- . Collectively, our findings suggest that MELs can be used as a potential ingredient that modulates AQP3 expression to improve skin moisturization following UVA irradiation-induced damage.
KEYWORDS
Aquaporin-3; JNK mitogen-activated protein kinases; Mannosylerythritol lipid; PPAR gamma; Ultraviolet
Mannosylerythritol lipids inhibit melanogenesis via suppressing ERK-CREB-MiTF-tyrosinase signalling in normal human melanocytes and a three-dimensional human skin equivalent
ABSTRACT
Hyperpigmentation is caused by excessive production of melanin in melanocytes. Mannosylerythritol lipids (MELs) are glycolipid biosurfactants that are abundantly produced by yeasts and used commercially in cosmetics. However, the potential depigmenting efficacy of MELs has not been evaluated. In this study, the depigmentary effect of MELs was tested in primary normal human melanocytes (NHMs), α-melanocyte- stimulating hormone (MSH)-stimulated B16 cells (murine melanoma cells) and a human skin equivalent (MelanoDerm) using photography, Fontana-Masson (F&M) staining and two-photon microscopy. Mannosylerythritol lipids significantly decreased the melanin contents in NHMs and α-MSH-stimulated B16 cells. Consistent with these findings, MELs treatment had a clear whitening effect in a human skin equivalent, brightening the tissue colour and reducing the melanin content. The molecular mechanism underlying the anti-melanogenic effect of MELs treatment was examined by real-time PCR and Western blotting. Mechanistically, MELs clearly suppressed the gene expression levels of representative melanogenic enzymes, including tyrosinase, Tyrp-1 and Tyrp-2, by inhibiting the ERK/CREB/MiTF signalling pathway in NHMs. This work demonstrates for the first time that MELs exert whitening effects on human melanocytes and skin equivalent. Thus, we suggest that MELs could be developed as a potent anti-melanogenic agent for effective whitening, beyond their use as a biosurfactant in cosmetics.
KEYWORDS
3-Dimensional human skin equivalent; Mannosylerythritol lipid; Melanogenesis