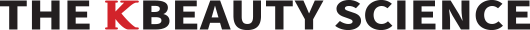KAIST 전기·전자공학부 전용민 박사과정, 최경철 교수 et al.


[더케이뷰티사이언스] KAIST 최경철 교수, 전용민 박사과정 연구원과 서울대학교 분당병원 박경찬 교수, 최혜령 연구원 연구팀이 플렉시블(Flexible) OLED를 이용하여 웨어러블(Wearable) 광치료 패치를 개발했다. 과학기술정보통신부·한국연구재단 기초연구사업(선도연구센터)의 지원으로 수행된 이 연구는 국제학술지 어드밴스드 머티리얼스 테크놀로지(Advanced Materials Technologies)에 2018년 3월 8일 게재되었다. 광치료는 빛을 쬐어 인체의 생화학반응을 촉진시키는 치료법으로 LED 또는 레이저 기기를 통해 상처를 치유하는데 널리 사용되어왔다. 그렇지만 기존 기기는 유연하지 못하고 균일하게 빛을 조사하기 어려우며 국부 발열문제가 있어 인체에 밀착할 수 없는 한계가 있었다. 연구팀이 개발한 광치료 패치는 가볍고 유연하여 피부에 부 착한 채 일상생활을 하면서 고효율 치료를 지속할 수 있는 장점을 갖고 있다. 디스플레이 분야에 응용되어온 OLED를 헬스케어 분야에 융합한 이 기술은 광치료 산업에 IT 기반의 ‘모바일 디지털 헬스케어’와 접목되어 완전히 새로운 ‘개인 맞춤형 e-헬스케어’의 중요한 축을 선점할 수 있을 것으로도 기대되고 있다. 어떻게 OLED를 이용하여 피부 치료 연구에 적용 할 수 있었는지 연구를 주도한 전용민 연구원에게 직접 물었다.


Photobiomodulation(PBM)란 무엇인가요? 작용메커니즘이 궁금한데요.
PhotobiomodulationPBM은 Photochemical therapy에 해당하는 광치료법 중 한 가지 방법이에요. Phototherapy는 크게 1W/cm2 이상의 고출력을 요구하는 Photothermal therapy와 100mW/cm2 미만의 상대적 저출력을 요구하는 Photochemical therapy로 구분됩니다. PBM은 저출력을 사용하는 방법으로 Low level light therapy(LLLT)라고도 많이 불리고 있으며, 기본적으로 미토콘드리아의 세포호흡을 증가하도록 하여 세포 활성화를 유도하도 록 하는 원리를 이용합니다. 정확한 작용메커니즘은 아직 명확하게 밝혀지지 않았지만, 가 장 유력하다고 알려져 있는 메커니즘은 미토콘드리아 내에 존재하는 시토크롬c 산화효소(Cytochrome c oxidase)라고 불리는 색소포에 의해 흡수되어, 세포호흡을 억제하는 NO를 미토콘드리아로부터 방출하도록 하고 ATP 합성 증가와 ROS가 증가하는 등의 생화학 작용이 발생한다는 것입니다. 이러한 생화학 작용의 촉진은 일반적으로 우리가 알고 있는 상처치유 효과, 모발 성장, 피부 재생 등 광치료에 효과가 있도록 하는 것이지요.
OLED를 이용해 피부에 적용하는 연구를 어떻게 시작하셨나요?
Organic Light-Emitting Diode(OLED)는 기본적으로 디스플레이와 조명에 가장 연구가 활발히 이루어져 상용화된 분야입니다. OLED는 박막(Thin film) 형태 제작이 가능하여 ‘플렉시블 OLED’로 제작이 가능한데요. 피부에 응용하고자 연구를 시작하게 된 것은 최경철 지도교수님의 아이디어에서 시작이 되었습니다. 최 교수님은 ‘차세대 플렉시블 디스플레이 융합 센터’의 센터장으로서 오랜 기간 플렉시블 및 웨어러블O LED의 원천 기술들을 연구해오셨어요. 그리고 이 플렉시블 OLED를 가지고 단순히 디스플레이 및 조명에 국한하여 적용하는 것이 아니라 피부에 부착할 수 있다면 바이오 분야에서 새로운 형태의 광치료법을 제시 할 수 있을 것 같다며 아이디어를 내셨지요. 사실 처음에는 피부는 생소했던 연구 분야였기 때문에 우리가 쉽게 접할 수 있는 여드름 치료를 타깃으로 연구를 진행했어요. 이후 서울대 학교 분당병원 박경찬 교수님 연구팀과 공동연구를 통해 피부 상처 치유에 적용할 수 있는 연구로 진행하게 되었습니다.
연구내용에 대해 소개해주세요.
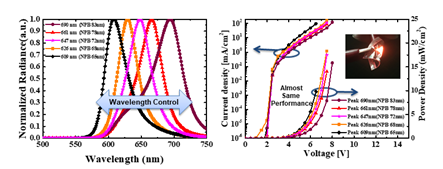
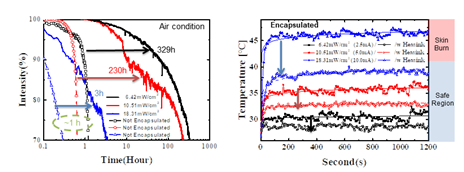
이번 연구는 인체에 부착 가능한 적색 파장의 플렉시블O LED를 활용하여 새로운 형태의 인 체 부착형 PBM 패치 플랫폼에 대한 내용을 담고 있습니다. 본 연구에 사용된 적색 파장의 플렉시블 OLED는 600~700nm 파장 영역을 마이크로 캐비티(Micro-cavity)효과로 자유롭게 조절가능 함을 입증하였고 8V내에서 20mW/cm2 수준의 높은 빛 출력 밀도 또한 확보했습 니다(그림 4). 부착가능하면서 손바닥만 한 크기의 PBM 패치는 플렉시블 OLED·배터리(Battery)·배리어(Barrier)·히트싱크(Heat sink)·패치(Patch) 등의 다양한 기능성 박막들을 포함하였음 에도 매우 가볍고(0.82g) 얇게(676μm) 제작되었어요. 뿐만 아니라 PBM 치료에 사용되는 빛 출력에서도 긴 구동수명(>300h), 유연성(20mm 굴곡 반경) 및 저온(<40°C) 구동이 가능하기 때문에 장소와 시간에 관계없이 광범위하고 안전한 광치료에 적용 할 수 있음을 확 인했습니다(그림 5). 적색 파장의 플랙시블 OLED를 다양한 조건의 섬유아세포Fibroblast에 적용하는 실험도 진행했는데, 기본적으로 사람의 내피를 구성하는 섬유아세포는 상처 치유 과정에서 중요한 역할을 하는 것으로 알려져 있어요. 실험 결과 효과적인 세포 증식(대조군 대비 58% 이상, 그림 6) 및 세포 이동속도(46% 이상, 그림 7)를 촉진시킴으로써 In vitro 측면에서 상처 치유의 우수한 효능을 확인했습니다.
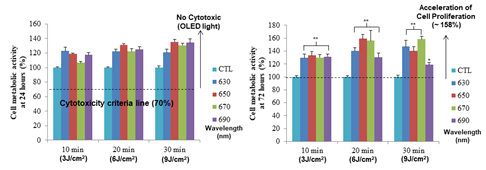
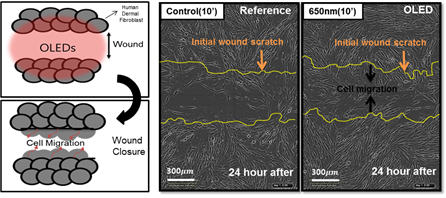
그림 4에서와 같이 광치료를 위해 플렉시블 OLED의 안정적인 파장 범위는 600~700nm인가요? 파장에 따른 특징이 있는지 궁금한데요.
일반적으로 광치료는 광원의 파장 범위에 따라 피부 투과길이가 달라지며(파장이 길수록 높은 투과율) 세포 종류에 따라 흡수하는 파장 영역이 다릅니다. 뿐만 아니라 조직 광학창 Tissue optical window 영역(600~1300nm)이외에는 헤모글로빈(Hemoglobin)과 수분에 의해 빛 흡수가 방해되어 파장의 선택 또한 중요하지요. 따라서 어떤 치료를 하느냐에 따라 필요한 특정 파장이 있게 됩니다. 결국 단순히 파장이 길다고 좋은 것은 아니라는 말이지요. LED 등을 이용한 상처치유와 같은 광치료에서는 600~700nm 사이 파장을 가장 많이 활용하고 있는데요. LED는 파장의 제어가 어려운 반면 OLED는 마이크로 캐비티 효과를 이용해 파장을 자유롭게 조절할 수 있는 장점을 갖습니다. 이렇게 파장을 제어하면서 최적화된 광치료 효과를 보일 수 있는 것이지요. OLED 마이크로 캐비티 효과는 일반적으로 유기물 및 전 극 두께 조절을 통해 얻을 수 있는데 본 연구에서는 유기물 중N PB(N,N′-di(1-naphthyl)- N,N′-diphenyl-(1,1′-biphenyl)-4,4′-diamine) 두께를 조절하여 파장을 조절했습니다. 그리고 600~700nm의 파장 내에서 NPB 두께에 따른 플렉시블 OLED의 성능 또한 거의 유사함을 확인하였지요.
기존 PBM 디바이스에 비해 어떤 차별점을 갖고 있나요?
기존의 PBM 디바이스들은 대부분 LED 및 레이저와 같은 딱딱한 점광원을 기반으로 제작 되었습니다. 따라서 넓은 면적을 커버할 때에는 다수의 광원을 배열(Array)하는 방식이 필요 하였는데요. 이에 따라 개발되는 디바이스가 굉장히 크고 무거워져 병원에 설치되어 광치 료를 진행해왔던 것입니다. 뿐만 아니라 다수의 광원을 배열하는 방식은 빛의 균일성에도 좋지 않고 특정 광량을 획득할 때 발생되는 강한 빛으로 인한 국부 발열 문제 등이 야기되었습니다. 결과적으로 이러한 특징 때문에 기존 디바이스들은 웨어러블 치료 응용에 한계점 을 갖게 된 것이지요. 우리가 개발한 플렉시블 OLED 패치는 이상적인 면광원으로 제작 가 능하고 두께도 수백nm 수준으로 매우 얇기 때문에 유연하게 만들어질 수 있는 장점을 갖고 있어요. 또한 면광원에서 빛이 균일하게 나와 대부분을 환부에 전달할 수 있고 얇고 가벼워 피부에 부착할 수 있지요. 매우 낮은 온도에서도 구동할 수 있기 때문에 국부 발열과 같은 문제도 걱정이 없어지게 됩니다. 이러한 플렉시블 OLED의 장점으로 기존과는 확연히 차별화된 부위에 상관없이 인체 부착이 가능한 광치료를 선보이는 웨어러블 PBM 패치 플랫폼을 제시할 수 있게 된 것이지요.
웨어러블 PBM 패치 OLED 모듈의 3.5 Dyads 캡슐화Encapsulation와 히트싱크 층에 대한 구조 얘기를 듣고 싶어요.
기존 PBM 디바이스를 위한 무기물로 제작되는 LED 광원과는 달리 OLED는 외부 산소 및 수분과 반응을 하면 소자 성능의 열화가 발생하게 됩니다. 이 때문에 OLED를 산소와 수분으로부터 보호할 수 있는 고성능의, 동시에 유연한 캡슐화 기술이 필요한데요. 이에 배리어 기능을 하는 무기 산화물 박막과 동시에 플렉시블 기능이 있는 고분자 폴리머(Polymer)를 번 갈아가면서 층층이 쌓아 올려 3.5 Dyads 캡슐화를 만들어냈습니다. 이 캡슐화로 유연성과 동시에 수분 및 산소로부터 OLED를 지키는 역할을 할 수 있는 것이지요. 또한, 인체에 부 착하기 위해서는 저온화상을 입지 않도록 42°C 이내의 매우 낮은 온도에서 구동될 수 있어 야합니다. 대부분의 파워에서 저온 구동을 확인했지만, 최대 파워에서도 안정적인 저온 구동 을 위해 히트싱크를 추가적으로 삽입하게 된 것입니다. 즉 이 OLED 모듈의 더 높은 신뢰성 을 위해서는 캡슐화와 히트싱크가 필요했고, 결과적으로 300시간 이상의 구동 수명과 42° C 이내의 저온 구동을 확보해냈습니다.
주로 플렉시블 디스플레이(Flexible display), 광전자공학(Optoelectronics), 나노적층물(Nanolaminate) 등 전기전자에 밀접한 연구주제들을 다뤄오셨는데, 피부 적용 연구를 통해 세포 실험을 진행하는 데 어려움은 없으셨나요?
공동연구를 하다 보니 제가 세포는 배양하지 않았어요. 그렇지만 제가 제작한 OLED로 실험할 때 직접 분당병원의 연구실로 올라가 연구원분과 함께 진행했습니다. 연구 분야가 다르기 때문에 부르는 명칭도 생소하고 어떻게 실험이 진행되는지 잘 모르기 때문에 오히려 더욱 직접 참여해야겠다는 생각을 갖게 되었어요. 처음에는 용어, 실험방법 등 모든 것이 낯설었지만 몇 년간 함께 실험을 진행해오면서 지금은 익숙해졌습니다.
연구를 진행하시면서 어려웠던 점이 있었다면?
제가 박사과정으로 OLED를 제작하고 연구하며 있는 곳은 대전이지만, 상처치유 등 OLED 의 효과에 관한 연구는 분당병원에서 진행이 되었습니다. 따라서 실험할 때마다 대전과 성 남을 왕복하며 다녔던 점이 가장 어려웠던 것 같아요. 연구를 바쁘게 진행할 때는 일주일 중 에 대전에 있는 시간보다 성남으로 출장을 가는 날이 더 많아서 대전으로 돌아오는 길이 출장 가는 느낌이 들 때도 있었어요. 그렇지만 이렇게 열심히 다니면서 실험 결과가 잘 도출되었을 때 뿌듯함과 성취감이 매우 컸습니다.
이 연구로 기대되는 성과가 있다면?
바이오/헬스케어 분야에서의 플렉시블 OLED의 새로운 응용방향을 제시했다는 점이 가장 기대되는 성과인 것 같아요. 플렉시블 OLED에 대한 연구는 예전부터 진행되어왔지만, 활용할 수 있는 분야가 마땅치 않아 상용화에 어려움이 있었기 때문이지요. 기존의 디스플레이, 조명이외에 다양한 광치료에 응용 가능성이 확인됨에 따라 제품화를 위한 사업화가 활발히 이루어질 수 있을 것이라고 생각해요. 예를 들면 최근 미용목적으로 인기가 많은 LED 마스크 등에 플렉시블 OLED로 대체 가능할 것으로 기대됩니다.
2018년 3월에 발표한 후 1년간 어떤 후속연구를 해 오셨는지 궁금한데요.
웨어러블 PBM 패치 플랫폼에 관련된 연구를 지속적으로 진행해오고 있어요. 논문에 게재 된 연구는 인체 섬유모세포에서만 PBM 상처치유 효과가 있음을 확인했기 때문에 더 나아가 각질형성세포에 대한 효과, 3D 인공피부모델에서의 상처치유 효과 등에 대해 연구 중입니다. 또한, PBM 뿐만 아니라 PDT 치료효과에 대한 연구도 진행 중인데요. 이러한 치유 효과와 더불어 플렉시블 OLED 광원에 대해서도 더욱 유연하고 저전압에서 강한 빛이 나오는 성능 및 신뢰성 향상 연구와 다양한 형태로 인체에 부착할 수 있는 연구를 진행하고 있습니다.
같은 연구 주제여도 저널의 특성에 따라 논문을 많은 저널에 게재하는 것이 쉽지 않다고 생각했는데, 다양한 저널에 발표할 수 있었던 비결이 있나요?
최경철 지도교수님과 연구실 구성원들의 도움이 있었기에 가능했다고 생각합니다. 가장 큰 비결인거지요. 우선 저희 교수님은 다양한 연구를 도전적으로 할 수 있도록 적극적인 지원을 항상 해주십니다. 본 연구 또한 제게 믿고 맡겨주셔서 더욱 책임감 있게 진행할 수 있었어요. 더불어 저희 연구실은 선후배분들의 내공으로 10년 이상 축적된 노하우를 언제든 공유할 수 있는 분위기인데요. 특히 25명의 많은 구성원들이 있어 경험하지 못했던 연구 분야, 저널 게재 및 학회 발표 등 다양한 부분에서 서로 많은 도움을 주고받을 수 있었어요. 논문에 게재할 때도 리뷰어(Reviewer)로부터 특정 의견 및 질문을 받으면, 대처할 수 있는 팁도 많이 받았지요.
박사학위 받은 이후에는 어떤 일을 하고 싶으신가요?
디스플레이에 관심이 많았던 저였기에 학부 때부터 정보디스플레이학과라는 특성화학과에 서 공부를 시작했어요. 이어 석박사과정도 저희 최경철 교수님 연구실에서 디스플레이 및 관련 응용연구를 진행하며 공부를 이어오고 있습니다. 확실한 분야를 정하진 못했지만 차세대 디스플레이 연구로 웨어러블 헬스케어 같은 응용연구를 하는 연구원을 꿈꾸고 있어요.
인터뷰를 끝내면서..
이번 인터뷰를 통해 제가 어떤 연구를 해왔고 앞으로 어떻게 나아가야 할지 등 제 자신을 다시 한 번 생각해보는 좋은 시간이었어요. 관련 후속 연구를 진행하고 있고 학계에도 곧 발표할 예정이니 지속적인 관심 가져주시면 감사하겠습니다.
A Wearable Photobiomodulation Patch Using a Flexible Red-Wavelength OLED and Its in vitro Differential Cell Proliferation Effects
ABSTRACT
Photobiomodulation (PBM) is a safe and noninvasive method that can provide various clinical effects. However, conventional PBM devices using point light sources, such as light-emitting diodes and lasers have various disadvantages, such as low flexibility, relatively heavy weight, and nonuniform effects. This paper presents a novel wearable PBM patch using a flexible redwavelength organic light-emitting diode (OLED) surface light source, which can be attached to the human body as a personalized PBM platform. The palm-sized wearable PBM patch can be very light (0.82 g) and thin (676 μm). It also has a reasonable operation life (>300 h), flexibility (20 mm bending radius), and low-temperature operation (<40 °C), and it can provide wide and safe application irrespective of location and time. Fibroblasts, a major type of dermal cells, play a key role in the wound healing process. The results show that OLEDs may have excellent in vitro wound healing effects because they effectively stimulate fibroblast proliferation (over 58% of control) and enhance fibroblast migration (over 46% of control) under various conditions. For maximum effect, peak wavelength control is necessary to optimize cell proliferation and enhance in vivo wound healing effects.
KEYWORDS
OLEDs, Patches, Photobiomodulation, Wearables, Wound healing
REFERENCES
[1] L. Gao, Y. Zhang, V. Malyarchuk, L. Jia, K.-I. Jang, R. C. Webb, H. Fu, Y. Shi, G. Zhou, L. Shi, Nat. Commun. 2014, 5, 4938.
[2] T. Q. Trung, N. E. Lee, Adv. Mater. 2016, 28, 4338.
[3] S. Xu, Y. Zhang, L. Jia, K. E. Mathewson, K.-I. Jang, J. Kim, H. Fu, X. Huang, P. Chava, R. Wang, Science 2014, 344, 70.
[4] S. Choi, J. Park, W. Hyun, J. Kim, J. Kim, Y. B. Lee, C. Song, H. J. Hwang, J. H. Kim, T. Hyeon, ACS Nano 2015, 9, 6626.
[5] C. Dagdeviren, Y. Su, P. Joe, R. Yona, Y. Liu, Y.-S. Kim, Y. Huang, A. R. Damadoran, J. Xia, L. W. Martin, Nat. Commun. 2014, 5, 4496.
[6] G. Schwartz, B. C.-K. Tee, J. Mei, A. L. Appleton, D. H. Kim, H. Wang, Z. Bao, Nat. Commun. 2013, 4, 1859.
[7] C. Wang, X. Li, E. Gao, M. Jian, K. Xia, Q. Wang, Z. Xu, T. Ren, Y. Zhang, Adv. Mater. 2016, 28, 6640.
[8] C. M. Lochner, Y. Khan, A. Pierre, A. C. Arias, Nat. Commun. 2014, 5, 5745.
[9] H. Chung, T. Dai, S. K. Sharma, Y.-Y. Huang, J. D. Carroll, M. R. Hamblin, Ann. Biomed. Eng. 2012, 40, 516.
[10] C. S. Jin, L. Cui, F. Wang, J. Chen, G. Zheng, Adv. Healthcare Mater. 2014, 3, 1240.
[11] M. R. Hamblin, T. N. Demidova, Proc. SPIE 2006, 6140, 614001.
[12] D. Barolet, C. J. Roberge, F. A. Auger, A. Boucher, L. Germain, J. Invest. Dermatol. 2009, 129, 2751.
[13] H. T. Whelan, R. L. Smits Jr., E. V. Buchman, N. T. Whelan, S. G. Turner, D. A. Margolis, V. Cevenini, H. Stinson, R. Ignatius, T. Martin, J. Clin. Laser Med. Surg. 2001, 19, 305.
[14] M. Elman, J. Lebzelter, Dermatol. Surg. 2004, 30, 139.
[15] E. S. Boschi, C. E. Leite, V. C. Saciura, E. Caberlon, A. Lunardelli, S. Bitencourt, D. A. Melo, J. R. Oliveira, Lasers Surg. Med. 2008, 40, 500.
[16] D. Barolet, A. Boucher, Lasers Surg. Med. 2008, 40, 106.
[17] B. Russell, N. Kellett, L. Reilly, J. Cosmet. Laser Ther. 2005, 7, 196.
[18] T. A. LeGates, D. C. Fernandez, S. Hattar, Nat. Rev. Neurosci. 2014, 15, 443.
[19] W. Ren, Y. Yan, L. Zeng, Z. Shi, A. Gong, P. Schaaf, D. Wang, J. Zhao, B. Zou, H. Yu, Adv. Healthcare Mater. 2015, 4, 1526.
[20] H. F. Iaccarino, A. C. Singer, A. J. Martorell, A. Rudenko, F. Gao, T. Z. Gillingham, H. Mathys, J. Seo, O. Kritskiy, F. Abdurrob, Nature 2016, 540, 230.
[21] R. J. Lanzafame, R. R. Blanche, A. B. Bodian, R. P. Chiacchierini, A. Fernandez-Obregon, E. R. Kazmirek, Lasers Surg. Med. 2013, 45, 487.
[22] S. Pfaff, J. Liebmann, M. Born, H. F. Merk, V. Von Felbert, Dermatology 2015, 231, 24.
[23] J. Petroski, Proc. SPIE 2002, 4776, 215.
[24] M. Jablonski, F. Bossuyt, J. Vanfleteren, T. Vervust, H. De Smet, SPIE Conf. 2014, 9129, 21.
[25] S. Song, Y. Sun, Y. Lin, B. You, Appl. Surf. Sci. 2013, 273, 652.
[26] K. Viravaidya-Pasuwat, C. Koaykul, S. Wong-in, Vol. 1, presented at BMEiCON, Fukuoka, Japan, November 2014.
[27] P. Moore, T. D. Ridgway, R. G. Higbee, E. W. Howard, M. D. Lucroy, Lasers Surg. Med. 2005, 36, 8.
[28] S. Pimputkar, J. S. Speck, S. P. DenBaars, S. Nakamura, Nat. Photonics 2009, 3, 180.
[29] M. S. White, M. Kaltenbrunner, E. D. Głowacki, K. Gutnichenko, G. Kettlgruber, I. Graz, S. Aazou, C. Ulbricht, D. A. Egbe, M. C. Miron, Nat. Photonics 2013, 7, 811.
[30] T. Yokota, P. Zalar, M. Kaltenbrunner, H. Jinno, N. Matsuhisa, H. Kitanosako, Y. Tachibana, W. Yukita, M. Koizumi, T. Someya, Sci. Adv. 2016, 2, e1501856.
[31] B. Geffroy, P. Le Roy, C. Prat, Polym. Int. 2006, 55, 572.
[32] D. Y. Kim, Y. C. Han, H. C. Kim, E. G. Jeong, K. C. Choi, Adv. Funct. Mater. 2015, 25, 7145.
[33] S.-M. Lee, J. H. Kwon, S. Kwon, K. C. Choi, IEEE Trans. Electron Devices 2017, 64, 1922.
[34] S. Kwon, W. Kim, H. Kim, S. Choi, B. C. Park, S. H. Kang, K. C. Choi, Adv. Electron. Mater. 2015, 1, 9.
[35] S. Choi, S. Kwon, H. Kim, W. Kim, J. H. Kwon, M. S. Lim, H. S. Lee, K. C. Choi, Sci. Rep. 2017, 7, 6424.
[36] W. Kim, S. Kwon, Y. C. Han, E. Kim, K. C. Choi, S. H. Kang, B. C. Park, Adv. Electron. Mater. 2016, 2, 11.
[37] C. Mignon, N. V. Botchkareva, N. E. Uzunbajakava, D. J. Tobin, Exp. Dermatol. 2016, 25, 745.
[38] M. A. Trelles, I. Allones, J. Cosmet. Laser Ther. 2006, 8, 39.
[39] D. Barolet, Semin. Cutaneous Med. Surg. 2008, 27, 227.
[40] X. Wu, S. Alberico, E. Saidu, S. Rahman Khan, S. Zheng, R. Romero, H. Sik Chae, S. Li, A. Mochizuki, J. Anders, Wound Repair Regener. 2015, 23, 104.
[41] B. Hu, W. Shi, Y. L. Wu, W. R. Leow, P. Cai, S. Li, X. Chen, Adv. Mater. 2014, 26, 5786.
[42] B. Hu, W. R. Leow, S. Amini, B. Nai, X. Zhang, Z. Liu, P. Cai, Z. Li, Y. L. Wu, A. Miserez, Adv. Mater. 2017, 29, 1700145.
[43] B. Hu, W. R. Leow, P. Cai, Y.-Q. Li, Y.-L. Wu, X. Chen, ACS Nano 2017, 11, 12302.
[44] J. L. Satino, M. Markou, Int. J. Cosmet. Surg. Aesthetic Dermatol. 2003, 5, 113.
[45] M. C. Gather, N. M. Kronenberg, K. Meerholz, Adv. Mater. 2010, 22, 4634.
[46] F. So, D. Kondakov, Adv. Mater. 2010, 22, 3762.
[47] Y. C. Han, E. G. Jeong, H. Kim, S. Kwon, H.-G. Im, B.-S. Bae, K. C. Choi, RSC Adv. 2016, 6, 40835.
[48] E. G. Jeong, S. Kwon, J. H. Han, H.-G. Im, B.-S. Bae, K. C. Choi, Nanoscale 2017, 9, 19.
[49] J. H. Kwon, E. Kim, H.-G. Im, B.-S. Bae, K. S. Chang, S.-H. K. Park, K. C. Choi, J. Inf. Disp. 2015, 16, 123.
[50] M. Groner, S. George, R. McLean, P. Carcia, Appl. Phys. Lett. 2006, 88, 051907.
[51] J.-S. Park, H. Chae, H. K. Chung, S. I. Lee, Semicond. Sci. Technol. 2011, 26, 034001.
[52] M. W. Dewhirst, B. Viglianti, M. Lora-Michiels, M. Hanson, P. Hoopes, Int. J. Hyperthermia 2003, 19, 267.
[53] D. G. Greenhalgh, M. B. Lawless, B. B. Chew, W. A. Crone, M. E. Fein, T. L. Palmieri, J. Burn Care Res. 2004, 25, 411.
[54] M. Ishiyama, Y. Miyazono, K. Sasamoto, Y. Ohkura, K. Ueno, Talanta 1997, 44, 1299.
[55] ISO 10993, International Organization for Standardization, 2009.
[56] J. Reinke, H. Sorg, Eur. Surg. Res. 2012, 49, 35.
[57] M. E. d. A. Chaves, A. R. d. Araújo, A. C. C. Piancastelli, M. Pinotti, An. Bras. Dermatol. 2014, 89, 616.
[58] L. G. Rodriguez, X. Wu, J.-L. Guan, Cell Migration: Developmental Methods and Protocols, Humana Press, Totowa, New Jersey 2005, p. 23.
[59] T. I. Karu, Proc. SPIE 2003, 5149, 60.
[60] J. Rheinwald, H. Green, J. Invest. Dermatol. 1975, 6, 331.