남윤성 교수 KAIST 신소재공학과
서론(Introduction)
피부는 크게 표피epidermis, 진피dermis, 피하조직subcutaneous layer을 포함하는 3층의 구조로 이루어져 있으며, 어떤 분자가 피부를 용이하게 투과할 수 있는 조건으로는 분자량은 500 Da 이하이고 지용성이여야 한다는 것이 일반적인 설명이다. 분자의 피부 침투는 주로 직접 세포투과 경로transcellular route, 세포간 경로intercellular route, 그리고 피부 부속기관을 통한 경로appendageal route를 통해서 이루어지는 것으로 단순화하여 설명한다. 하지만, 특정 분자가 실제로 어떤 과정을 통해 분자가 피부를 침투하게 되는지, 그 과정을 정확하게 밝히는 것은 쉬운 일이 아니며, 우리는 여전히 매우 제한적인 정보만 갖고 있다. 물론, 경구 투여와 비교 가능한 수준의 저분자량 약물의 피부 투과는 위의 단순화된 설명이 좋은 지침이 될 수 있으나, 매우 적은 양으로도 생리활성의 변화를 유도할 수 있는 분자의 피부 침투는 전혀 다른 수준의 이해가 필요하며, 실험적인 증명도 훨씬 까다롭다. 예를 들어, 단백질이나 유전자와 같은 거대 생체분자의 피부 투과는 저분자량 약물의 피부 투과에 익숙한 연구자들에게는 매우 어리석은 시도로 간주될 수 있다. 이미 우리 몸 안에 너무 많이 존재하기 때문에 구조 변화와 정량 분석을 동시에 하는 것은 거의 불가능하며, 피부 조직의 왕성한 대사활동을 고려하면 전달하고자 하는 거대 생체분자들이 피부 안에 온전한 형태로 유지되리라고 가정하기도 어렵다. 하지만, 많은 실험결과들은 거대 생체분자들이 피부에 도포되어 의미 있는 수준의 생리활성 변화를 유도하는 것을 보고하고 있다.
개인 맞춤형 의약품이라는 개념으로 유전자를 이용해 질병을 예방하거나 치료하는 유전자 치료 기술은 지난 수 십 년동안 활발한 연구가 이루어졌다. 특히, 피부를 통해 유전자를 전달하는 것은 간을 경유하지 않고 혈액 내에서 제거되는 것을 우회할 수 있어 생체이용률을 높이고 부작용을 줄일 수 있는 장점이 있어서, 전신 투여에서 발견되는 낮은 타깃 전달 효율을 극복할 수 있는 대안으로 주목받고 있다. 궁극적으로는 더 안전하고 효과적으로 피부의 생리활성을 조절하기 위한 기술로 화장품에도 적용될 수 있을 것이다. 하지만, 아직은 유전자 전달 기술의 완성도가 많이 떨어져서 실제로 임상에 적용되거나 상용화된 것은 극히 일부에 지나지 않는다. 이번 리뷰에서는 피부를 통해 유전자를 전달하는 기술들을 소개하고, 이러한 기술들이 유전자를 이용한 질병 예방 및 치료뿐 아니라 화장품 개발에도 적용될 수 있는지를 살펴보고자 한다.
세포 투과성 펩타이드(Cell-penetrating peptides)
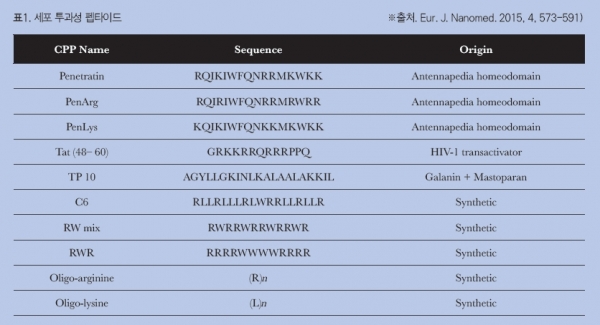
세포 투과성 펩타이드cell-penetrating peptides, CPP는 10~30개 정도 길이의 짧은 펩타이드로 다양한 외부 물질들을 세포 내부로 전달을 용이하게 하는 특징을 갖고있다. 이러한 특성으로 인해서 다양한 아미노산 서열의 세포 투과성 펩타이드들을 이용한 약물 및 유전자의 세포 내 전달에 관한 연구가 폭넓게 이루어지고 있다.[1] 세포 내부로 전달되는 기전으로 세포막으로 직접 침투하는 경로, 세포내이입endocytosis을 통해 유입되는 경로, 또는 일시적으로 구조체를 형성하여 세포막을 투과하는 경로 등에 대한 가설들이 보고되고 있으나 정확한 기전에 대한 연구는 아직 진행 중에 있다.[2]
세포 투과성 펩타이드를 이용한 유전자 전달에는 세포 투과성 펩타이드와 유전자의 화학적 결합을 통한 결합체conjugates 제조나 정전기적 인력에 의한 나노복합체 형성을 통한 방법이 주로 사용된다.[3] 소간섭 리보핵산small interfering RNA, siRNA을 세포 투과성 펩타이드에 결 합시킴으로써 피부 내로의 흡수를 증가시키고 표적 유전자의 발현을 효과적으로 저하 시킬 수 있음이 보고된 바 있다.[4][5] 양이온성 세포 투과성 펩타이드와 음이온성 DNA는 나노 복합체를 형성하여, 이렇게 형성된 나노복합체는 표피를 투과하여 기저층 세포까지 전달시 켜 투입된 유전자를 발현시킬 수 있다는 것도 확인되었다.[6]. 또한 나노입자의 표면에 세포 투과성 펩타이드를 처리함으로써 나노입자의 세포 내 전달을 향상 시킬 수도 있다.[7]
리포좀(Liposomes)
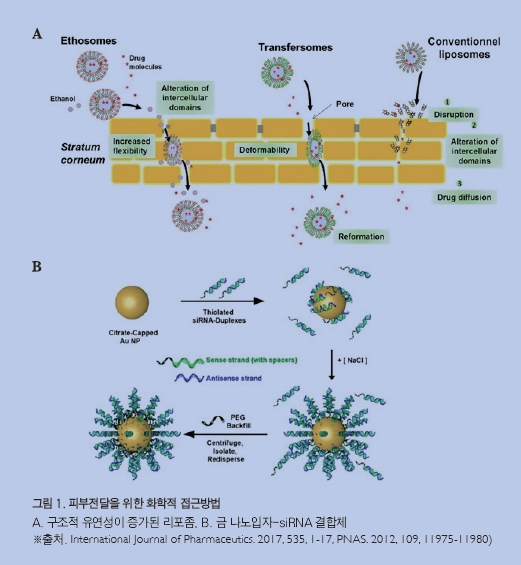
리포좀liposomes은 지질 이중층을 갖는 구형의 소포체로서, 극성 및 비극성 물질을 담지할 수 있어 약물전달체로 활용하는 연구가 많이 이루어져 왔다.[8] 생체막 또는 각질층의 세포 간 지질과 유사한 구성성분 및 구조를 가지기 때문에 생체친화적일 뿐 아니라 담지된 약물을 피부 깊숙한 세포로 전달할 수 있다. 양이온성 리포좀은 DNA와 복합체를 형성할 수 있어 포집 효율이 높으며, DNA를 분해효소로부터 보호함과 동시에 세포내 전달을 촉진 시킬 수 있다. 예를 들어, DOTAP(N-[1-(2,3-Dioleoyloxy)propyl]-N,N,N-trimethylammonium)과 DC-Chol(3ß-[N-(N',N'-dimethylaminoethane)-carbamoyl]cholesterol)/DOPE(1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine)의 양이온성 리포좀을 DNA 전달에 사용하여 표피에 원하는 항원 유전자를 발현시켜 효과적인 항체 면역반응을 유도 하였다. [9]
최근, 리포좀의 피부 침투를 더욱 증대시키기 위해 입자 구조적으로 유연flexibility하고 변형deformability이 쉬운 소포체를 제조하여 각질 세포 사이의 공간을 잘 통과하도록 하는 연구가 진행되고 있다. 대표적으로 계면활성제나 에탄올 같은 첨가제를 추가하여 리포좀을 구조적으로 유연하게 만든 에토좀ethosome과 트렌스퍼좀transfersome 등이 있다.[10] 이러한 리포좀에 siRNA를 담지하게 되면 siRNA의 피부 침투능이 훨신 증가한다고 보고된 바 있다.
또한, 건선psoriasis 모델에서 siRNA로 질환 유전자인 베타-디펜신beta-defensin 유전자를 억제해 피부질환 치료제 개발에 사용될 수 있음을 보여주었다[1. 1]
나노소재(Nanomaterials)
다양한 나노 소재를 이용한 유전자 전달 시스템의 개발도 매우 활발하게 진행되었다. 이러한 나노 소재 기반 전달 시스템은 단백질 나노입자, 고분자 나노입자, 무기 나노입자, 탄소 기반 나노구조체 등이 있다.[12] 유전자의 피부 전달에도 이러한 나노 소재들이 쓰이기 시작하고 있다. 특히, 금 나노입자의 경우 높은 생체적합성을 갖고 있고, 합성 및 표면 개질도 매우 용이한 편이라서 그 응용 연구가 폭 넓게 진행되었다. 금 나노입자 표면에 siRNA를 결합시킨 형태의 금 나노입자-siRNA 결합체를 피부에 도포하면, 표피 및 진피까지 금 나 노입자-siRNA 결합체가 침투하여 목적 유전자 발현을 거의 완벽히 저해할 수 있다는 것도 보고되었다.[13] 이 시스템을 상처 치유 저해인자를 표적하는 siRNA를 적용할 경우 상처 치유를 촉진시키는 효과가 있었다.[14] 세포 투과성 펩타이드와 양이온성 고분자로 코팅된 금 나노입자를 이용하여 DNA의 피부 침투능을 증가시킬 수도 있다.[15]
안전성 측면에서 보다 심도있는 연구가 필요하지만, 탄소나노튜브carbon nanotubes를 siRNA 의 피부흡수에 적용시킨 경우도 있다.[16] 단일벽 탄소나노튜브 표면을 양이온성 고분자로 기능화시켜, 여기에 siRNA를 정전기적으로 결합하여 복합체를 흑색종melanoma 마우스 모델의 피부에 처리한 경우, siRNA가 암 조직까지 전달되어 목표한 종양 유전자를 억제하였고, 종양세포의 성장도 억제되어 항암 치료제로서 우수한 효과가 있음을 확인하였다.
전기천공법(Electroporation)
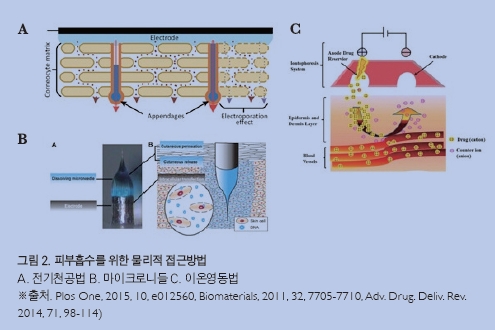
전기천공법은 피부 미용 장치로서 피부에 강한 전류를 가함으로써 순간적으로 공극을 형성 하여 피부 내로 화장품의 주요 성분들의 흡수와 침투를 향상시키는 기술이다.[17][18] 피부는 인지질 구조로 이루어져 있어 외부로부터 수분과 친수성 물질의 투과를 억제하는 중요한 기능을 수행한다. 그러나, 피부 표면에 강한 전류를 가하면 순간적으로 인지질 구조가 붕괴되어 피부 공극이 발생한다. 이러한 현상을 이용하여 피부에 화장품을 도포한 후 진동과 함께 강한 전류 자극을 줌으로써 화장품의 주요 성분들이 피부 내로 보다 용이하게 흡수될 수 있도록 한다. 사실 DNA를 세포 내부로 전달해서 유전자를 발현시키는 방법은 이미 1970년대부터 널리 사용되었지만, 피부를 대상으로 전기천공법을 사용하기 시작한 것은 1990년대 초반이다. 극성 물질인 칼세인calcein, 623 Da, 루시퍼 옐로lucifer yellow, 457 Da, 에리쓰로신 유도체 erythrosine derivative, 1025 Da의 흡수율을 피부 도포 방식보다 최대 4배 증가시킨 것이 보고된 바 있다.[19] 최근에는 이러한 전기천공법을 피부 내 유전자를 직접 전달에 활용하여 미백, 색소침착 감소, 주름 개선, 피부탄력 증가에 대한 연구가 활발히 진행되고 있다.[20][21][22]
마이크로니들(Microneedles)
마이크로니들은 초미세 주사 바늘이 규칙적으로 배열된 패치로 피부에 붙이면 피부 표면을 뚫고 들어가 진피 깊숙이 마이크로니들 표면에 흡착된 화장품의 주요 성분들이 피부 내로 스며들어 전달될 수 있도록 한다.[23][24] 마이크로니들은 각질층을 최소한으로 파괴하여 조직 손상이나 통증이 거의 없고 피부 속까지 주요 성분들을 빠르게 전달할 수 있는 장점이 있다. 최근에는 피부 내에서 녹는 재질로 만들어진 마이크로니들에 화장품의 주요 성분들 을 넣어 화장품 패치로 개발하는 기업들이 점차 증가하고 있다.[25] 이러한 기술은 피부 내 유전자를 직접전달하는데 적용되어 흉터치료, 피부 민감성 및 염증 억제 등의 효과를 가진 화장품 패치 개발에 응용되고 있다.
미세다륜침(Microneedle therapy system, MTS)
미세다륜침은 수백 개의 미세한 침으로 만들어진 롤러 형태의 기기로 피부 표면을 뚫어 진피 깊숙이 마이크로홀이 만들어져 화장품의 주요 성분들이 피부 내로 깊숙이 전달될 수 있도록 한다.[26] 피부 표면에 생성된 미세상처인 마이크로홀은 세포 스스로의 상처회복wound healing 과정을 통해 자연적으로 치유된다. 화장품의 극성과 비극성 주요 성분들을 고농도로 모두 전달할 수 있는 장점이 있다. 주로 피부성장인자 단백질과 펩타이드 그리고 미백 성분인 알부틴과 비타민 C의 피부 내 전달에 사용되고 있다. 바늘의 크기는 0.25~2.0mm이고 사용 시 피부 표면에 통증이 유발되어 국소마취제 크림에 사용되기도 한다. 또한, 외부의 유해 물질이 함께 피부 내로 전달되는 잠재적 위험성이 있다.
이온영동법(Iontophoresis)
이온영동법은 (+)극과 (-)극을 이용하여 피부 전위차를 주어 피부의 전기적 환경을 변화시킴으로써 화장품의 이온성 주요 성분들의 피부 투과를 증가시키는 방법이다.[27] 이러한 방 법은 비타민 C를 피부 내로 효과적으로 전달시켜 멜라닌세포를 억제하여 기미 생성을 줄이 고 콜라겐 형성을 촉진시켜 주름치료에 사용되고 있다. 장점으로는 통증이 적고 국소적으 로 높은 농도를 피부내로 전달할 수 있어 즉각적인 효과를 볼 수 있다. 그러나, 피부에 적용 하는 전류 세기를 증가시켜 주요 성분의 흡수율은 증가되는 반면, 홍반, 가려움, 화상 등의 피부 부작용이 발생하여 적절한 전류의 세기를 찾는 것이 중요하다. 최근에 이러한 방법을 이용해 siRNA 유전자 치료제를 아토피 동물모델에 적용, 아토피 염증 인자의 발현을 효과 적으로 억제하여 아토피를 개선한 연구결과가 있다.[28]
고찰 및 결론
피부는 외부 유해물질의 침투와 수분 증발을 보호하는 단단한 벽으로 이루어진 장벽 역할을 한다. 그러나 견고한 피부 장벽은 유익한 성분들 마저도 피부 내 침투를 차단하여 그 효과를 발휘하지 못하게 한다. 현재 화장품 분야에서 피부 흡수를 촉진시키기 위해 다양한 화학적 또는 물리적 접근법을 이용하여 화장품의 주요 성분들을 피부 내 전달을 용이하게 한다. 지금까지 피부미백제, 주름개선제, 자외선차단제 등 기능성 화장품의 주요 성분에는 주로 합성 분자들, 펩타이드, 단백질 등이 사용되었다. 최근에 와서는 피부 조직을 유전자 분석을 통해 확인한 후 제조하는 개인별 맞춤형 화장품 제조사가 등장하였다. 개인별 맞춤형 화장품의 주요 성분 중 하나로 큰 주목을 받고 있는 것이 유전자이다. 많은 국내외 학술지에서 기존의 화학 및 물리적 접근법을 통해 피부 내 유전자를 효과적으로 전달하여 주름개선, 염증억제, 미백효과, 흉터치료 등에 탁월한 효과를 검증하였다. 유전자를 피부 내로 효과적이고 안정하게 전달하는 접근법에 더 많은 연구가 필요하지만, 유전자는 화장품의 새로운 기능성 주요 성분 물질로서의 활용이 더욱 커질 것이라고 전망한다.
참고 문헌
[1] L. Vasconcelos, K. Parn, U. Langel, Therapeutic potential of cell-penetrating peptides, Ther Deliv, 4 (2013) 573-591.
[2] S. Trabulo, A.L. Cardoso, M. Mano, M.C. De Lima, Cell-Penetrating Peptides-Mechanisms of Cellular Uptake and Generation of Delivery Systems, Pharmaceuticals (Basel), 3 (2010) 961-993.
[3] P. Boisguerin, S. Deshayes, M.J. Gait, L. O'Donovan, C. Godfrey, C.A. Betts, M.J. Wood, B. Lebleu, Delivery of therapeutic oligonucleotides with cell penetrating peptides, Adv Drug Deliv Rev, 87 (2015) 52-67.
[4] T. Hsu, S. Mitragotri, Delivery of siRNA and other macromolecules into skin and cells using a peptide enhancer, P Natl Acad Sci USA, 108 (2011) 15816-15821.
[5] C.M. Lin, K. Huang, Y. Zeng, X.C. Chen, S. Wang, Y. Li, A simple, noninvasive and efficient method for transdermal delivery of siRNA, Arch Dermatol Res, 304 (2012) 139-144.
[6] M. Vij, P. Natarajan, B.R. Pattnaik, S. Alam, N. Gupta, D. Santhiya, R. Sharma, A. Singh, K.M. Ansari, R.S. Gokhale, V.T. Natarajan, M. Ganguli, Non-invasive topical delivery of plasmid DNA to the skin using a peptide carrier, J Control Release, 222 (2016) 159-168.
[7] Y.X. Yang, Y.F. Jiang, Z. Wang, J.H. Liu, L. Yan, J.X. Ye, Y.Z. Huang, Skin-permeable quaternary nanoparticles with layer-by-layer structure enabling improved gene delivery, J Mater Chem, 22 (2012) 10029-10034.
[8] L. Sercombe, T. Veerati, F. Moheimani, S.Y. Wu, A.K. Sood, S. Hua, Advances and Challenges of Liposome Assisted Drug Delivery, Front Pharmacol, 6 (2015) 286.
[9] J.Y. Cheng, H.N. Huang, W.C. Tseng, T.L. Li, Y.L. Chan, K.C. Cheng, C.J. Wu, Transcutaneous immunization by lipoplex-patch based DNA vaccines is effective vaccination against Japanese encephalitis virus infection, J Control Release, 135 (2009) 242-249.
[10] B. Geusens, M. Van Gele, S. Braat, S.C. De Smedt, M.C.A. Stuart, T.W. Prow, W. Sanchez, M.S. Roberts, N.N. Sanders, J. Lambert, Flexible Nanosomes (SECosomes) Enable Efficient siRNA Delivery in Cultured Primary Skin Cells and in the Viable Epidermis of Ex Vivo Human Skin, Adv Funct Mater, 20 (2010) 4077-4090.
[11] E. Desmet, S. Bracke, K. Forier, L. Taevernier, M.C. Stuart, B. De Spiegeleer, K. Raemdonck, M. Van Gele, J. Lambert, An elastic liposomal formulation for RNAi-based topical treatment of skin disorders: Proof-of-concept in the treatment of psoriasis, Int J Pharm, 500 (2016) 268-274.
[12] M.K. Riley, W. Vermerris, Recent Advances in Nanomaterials for Gene Delivery-A Review, Nanomaterials (Basel), 7 (2017).
[13] D. Zheng, D.A. Giljohann, D.L. Chen, M.D. Massich, X.Q. Wang, H. Iordanov, C.A. Mirkin, A.S. Paller, Topical delivery of siRNA-based spherical nucleic acid nanoparticle conjugates for gene regulation, P Natl Acad Sci USA, 109 (2012) 11975-11980.
[14] P.S. Randeria, M.A. Seeger, X.Q. Wang, H. Wilson, D. Shipp, C.A. Mirkin, A.S. Paller, siRNA-based spherical nucleic acids reverse impaired wound healing in diabetic mice by ganglioside GM3 synthase knockdown, P Natl Acad Sci USA, 112 (2015) 5573-5578.
[15] J. Niu, Y. Chu, Y.F. Huang, Y.S. Chong, Z.H. Jiang, Z.W. Mao, L.H. Peng, J.Q. Gao, Transdermal Gene Delivery by Functional Peptide-Conjugated Cationic Gold Nanoparticle Reverses the Progression and Metastasis of Cutaneous Melanoma, Acs Appl Mater Inter, 9 (2017) 9388-9401.
[16] K.S. Siu, D. Chen, X.F. Zheng, X.S. Zhang, N. Johnston, Y.L. Liu, K. Yuan, J. Koropatnick, E.R. Gillies, W.P. Min, Non-covalently functionalized single-walled carbon nanotube for topical siRNA delivery into melanoma, Biomaterials, 35 (2014) 3435-3442.
[17] J.L.V. Luna, M. Krenn, J.A.C. Ramirez, W. Mayr, Dynamic Impedance Model of the Skin-Electrode Interface for Transcutaneous Electrical Stimulation, Plos One, 10 (2015) e0125609.
[18] V. Preat, M.R. Prausnitz, Enhanced drug delivery using high-voltage pulses, Adv Drug Deliver Rev, 35 (1999) 1-2.
[19] M.R. Prausnitz, V.G. Bose, R. Langer, J.C. Weaver, Electroporation of Mammalian Skin - a Mechanism to Enhance Transdermal Drug-Delivery, P Natl Acad Sci USA, 90 (1993) 10504-10508.
[20] S. Kos, K. Vanvarenberg, T. Dolinsek, M. Cemazar, J. Jelenc, V. Preat, G. Sersa, G. Vandermeulen, Gene electrotransfer into skin using noninvasive multi-electrode array for vaccination and wound healing, Bioelectrochemistry, 114 (2017) 33-41.
[21] S. Kos, T. Blagus, M. Cemazar, U.L. Tratar, M. Stimac, L. Prosen, T. Dolinsek, U. Kamensek, S. Kranjc, L. Steinstraesser, G. Vandermeulen, V. Preat, G. Sersa, Electrotransfer parameters as a tool for controlled and targeted gene expression in skin, Mol Ther-Nucl Acids, 5 (2016).
[22] S. Kos, N. Tesic, U. Kamensek, T. Blagus, M. Cemazar, S. Kranjc, J. Lavrencak, G. Sersa, Improved Specificity of Gene Electrotransfer to Skin Using pDNA Under the Control of Collagen Tissue-Specific Promoter, J Membrane Biol, 248 (2015) 919-928.
[23] T.M. Tuan-Mahmood, M.T.C. McCrudden, B.M. Torrisi, E. McAlister, M.J. Garland, T.R.R. Singh, R.F. Donnelly, Microneedles for intradermal and transdermal drug delivery, Eur J Pharm Sci, 50 (2013) 623-637.
[24] S. Bhatnagar, K. Dave, V.V.K. Venuganti, Microneedles in the clinic, J Control Release, 260 (2017) 164-182.
[25] N.G. Rouphael, M. Paine, R. Mosley, S. Henry, D.V. McAllister, H. Kalluri, W. Pewin, P.M. Frew, T.W. Yu, N.J. Thornburg, S. Kabbani, L.L. Lai, E.V. Vassilieva, I. Skountzou, R.W. Compans, M.J. Mulligan, M.R. Prausnitz, T.M.S. Grp, The safety, immunogenicity, and acceptability of inactivated influenza vaccine delivered by microneedle patch (TIV-MNP 2015): a randomised, partly blinded, placebo-controlled, phase 1 trial, Lancet, 390 (2017) 649-658.
[26] Y. Choi, H. Ahn. The effect of microneedle therapy system to imporve the facial skin conditions for mid-aged women. Kor J Aesthet Cosmetol, 10 (2012) 611-618.
[27] 조완구, 랑문정, 송영숙, 임영호, 박현우, Flexible Thin Layer Battery가 부착된 lontophoretic Gel Patch를 이용한 Vitamin C 유도체의 경피 흡수 증진, 대한화장품학회지, 33 (2007) 23-28.
[28] K. Kigasawa, K. Kajimoto, S. Hama, A. Saito, K. Kanamura, K. Kogure, Noninvasive delivery of siRNA into the epidermis by iontophoresis using an atopic dermatitis-like model rat, Int J Pharmaceut, 383 (2010) 157-160.