초록
산소에 의한 산화 스트레스 oxidative stress는 산소 호흡을 하는 생물체에서는 필연적으로 발생하는 부산물로서 단백질이나 지질, 탄수화물 등 모든 생체 구성 물질의 기능과 구조를 변형시키고, 궁극적으로 노화를 유발하는 요인이다. 호흡에 의한 산소 라디칼의 발생 뿐만 아니라 자외선, 열, 미세 먼지 등의 외부 자극원에 의해 생체 내에서 발생하는 다양한 활성 산소종Reactive Oxygen Species: ROS이 산화 스트레스를 일으키게 된다. 생체는 이러한 산화 스트레스에 대응하기 위한 다양한 항산화 기전을 사용하고 있다. 생체의 항산화 시스템에는 크게 비타민 E와 같은 항산화 물질을 이용하여 직접적으로 산화 스트레스를 해소하는 기전과 초과산화물 불균등화효소superoxide dismutase: SOD 등과 같이 활성 산소종을 분해하여 산화 스트레스를 완화하는 효소 시스템 등이 있다. 특히 피부는 인체가 외부에 직접적으로 맞닿는 첫번째 기관으로서 가장 다양한 종류의 산화 스트레스에 끊임없이 노출되어 있다. 본 글에서는 산화 스트레스에 의한 피부의 변화와 피부 내 항산화 시스템에 대하여 설명하고자 하며, 특히 자가포식autophagy 기전에 의한 항산화 시스템의 조절 기작에 대해 논의하고자 한다.
들어가며
산소 호흡을 통해 에너지를 얻는 생물체에서, 산소에 의한 산화 스트레스는 높은 효율의 에너지 생산을 위해서 감내해야 하는 필연적인 부작용이라 할 수 있다. 활성 산소종Reactive Oxygen Species은 산소 호흡의 마지막 단계에서 미토콘드리아 내부에서 발생하는 과산화수소hydrogen peroxide에 의해 발생하는 다양한 산소 라디칼 분자를 통칭하는 단어이다(S. Miwa, F. L. Muller & K. B. Beckman, 2008). 수퍼옥사이드superoxide, 수산화 라디칼hydroxy radical, 수산화 과산화물 라디칼hydroxyperoxide radical 등 다양한 형태의 분자로 존재하면서 여타의 단백질이나, 지질, DNA 등을 산화하는 역할을 하게 된다. 노화의 원인과 경로를 설명하고자 하는 다양한 노화 이론 중 특히 자유 라디칼 이론에서는 이러한 활성 산소종이 유전자, 단백질, 지질 등에서 분자 수준의 손상을 일으키며, 이러한 손상이 누적되면서 세포, 조직, 기관, 생체 수준으로 영향을 미쳐 노화를 유발하는 것으로 설명하고 있다 (Rinnerthaler, Bischof, Streubel, Trost, & Richter, 2015). 이에 따라, 자유 라디칼을 효과적으로 제어하는 것이 노화 과정을 억제하고 노화에 동반되는 많은 퇴행성 질환 또는 변화를 조절할 수 있는 효과를 기대할 수 있다.
이러한 산화 스트레스에 대응하기 위해 생체에서는 다양한 항산화 시스템이 작동되고 있다. 항산화 시스템에는 크게 효소를 이용하는 방법과 효소가 관여하지 않는 방법이 있으며, 효소를 이용한 항산화 시스템에서는 초과산화물 불균등화효소superoxide dismutase: OSD, 카탈레이즈catalase, 글루타치온 퍼옥시데이즈glutathione peroxidase 등 라디칼 물질을 직접적으로 분해하는 효소가 관여하고 있다 (Yang & Lee, 2015). 비효소 시스템으로서는 비타민 C, E, 베타카로틴, CoQ10 등과 같은 항산화 물질을 통해 활성 산소종을 제거하는 기작이 알려져 있다(Gašperlin & Gosenca, 2011). 이와 함께 산화 스트레스에 의한 손상, 특히 유전자에서 나타나는 손상을 제거하거나 교정하는 효소 시스템도 잘 알려져 있다.
Ⅰ 피부와 산화 스트레스
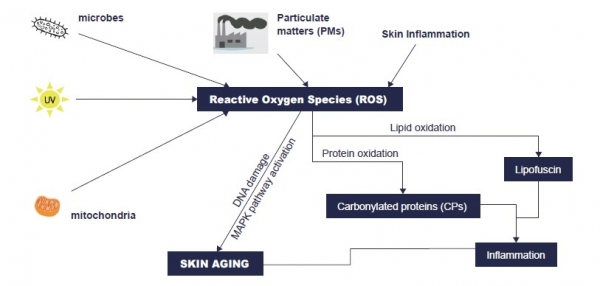
피부는 인체의 가장 바깥에서 외부 환경에 대응해서 내부의 항상성을 유지하는 기능을 수행하는 기관이라 할 수 있다. 생체의 생존에 필수적인 이러한 장벽 기능은 주로 표피, 특히 각질층에 의해서 수행되는 것으로 알려져 있으며 이러한 장벽 기능의 손상은 피부 건조, 민감도 증가, 색소 침착 뿐만 아니라 피부의 국소적인 염증 발생 등을 유발하는 요인으로 보고된 바 있다. 피부는 외부 환경과 직접적으로 맞닿아있는 조직이라는 점에서 호흡 등에 의해 생성되는 산화 스트레스 외에 생체 외부에서도 직접적으로 산화적 손상을 받을 수 있다 (Poljsak, Dahmane, & Godic, 2013). 예를 들면 자외선이나 X-선 등의 강한 에너지원에 노출되는 경우 세포 내에서 다양한 라디칼 물질이 생성되는 것으로 보고된 바 있으며, 최근 적외선이나 청색광 등과 같이 비교적 낮은 에너지원에 의해서도 피부 내 표피층이나 진피층에서 산화 스트레스가 발생하는 것으로 보고되고 있다(Mamalis, Koo, & Jagdeo, 2016). 이와 함께, 최근 미세먼지particulate matter: PM 내에 포함된 다양한 유기 화합물이나 중금속 등도 피부에서 산화 스트레스를 일으키는 것으로 제시되고 있다(Kim, Cho, & Park, 2016), (Vierkötter et al., 2010).
피부의 산화 스트레스에 의해 발생하는 가장 대표적인 물질 중 하나인 lipofuscin은 단백질과 지질, 탄수화물이 결합하여 만들어지는 물질로서, 노화 과정에서 흔히 나타나는 색소 침착age spot 의 원인 물질로 보고된 바 있다 (Höhn, Sittig, Jung, Grimm, & Grune, 2012). 따라서 이러한 lipofuscin의 생성을 억제하거나 이미 만들어진 lipofuscin을 없애는 효과를 가진 저분자 물질이나 천연 추출물을 이용하여 미백 성분 또는 항노화 화장품 원료로 개발하고자 하는 노력이 꾸준히 이어지고 있다. 단백질의 산화에 의해 생성되는 탄화 단백질carbonylated protein 역시 피부의 노화를 유발하는 주요한 원인 중 하나로 제시되고 있으며, 특히 피부의 최외각인 각질층에서 탄화 단백질은 투명도를 낮추고, 피부 장벽 기능의 악화와 각질층 내 수분도의 감소 등을 일으키는 것으로 보고된 바 있다J Dermatol Sci (2016) 84: e133. 최근 저자 등은 이러한 각질층 내 탄화 단백질의 양이 피부의 탄력과 상관 관계를 가지고 있다는 것을 보고한 바 있으며, 특히 피부 세포에서 자가포식을 활성화하는 효과를 지닌 물질을 도포하여 이러한 탄화 단백질의 생성을 효과적으로 억제할 수 있음을 밝혀낸 바 있다(Lim et al., 2018).
Ⅱ 자가포식과 산화 스트레스
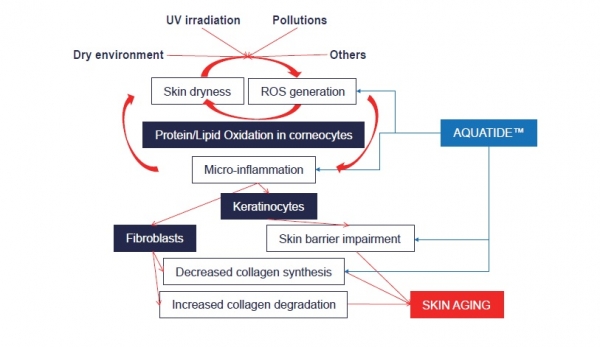
자가포식autophagy은 세포가 영양분의 부족 등을 포함한 외부 환경의 변화에 대응해서 세포 내 소기관을 분해하여, 세포 내 에너지원으로 재활용하는 과정이라 할 수 있다 (Young & Narita, 2010). 이러한 에너지 유지 및 조절 기능 외에도 자가포식은 손상된 세포 내 소기관이나 외부에서 유입된 미생물 등을 제거하는 세포 보호의 역할도 수행하는 것으로 알려져 있다. 이와 함께 자가포식에 의해 산화 스트레스에 의해 손상된 물질 또는 세포 내 소기관을 제거하는 것이 밝혀진 바 있으며, 특히 세포 내에서 항산화 시스템에 관여하는 많은 효소의 발현을 조절하는 역할을 하는 것으로 알려지면서(Li, Tan, Miao, Lei, & Zhang, 2015), (Lee, Giordano, & Zhang, 2012; Lim et al., 2017), 자가포식 기전을 바탕으로 한 다양한 화장품 원료와 제품 등이 연구, 개발되고 있다. 최근 많은 수의 원료와 제품이 소개되고 있으나, 대다수의 자가포식 관련 원료가 주로 천연물을 기반으로 그 작용 기전이나 세포 또는 피부 수준에서 효능이 명확하게 밝혀진 것은 많지 않은 실정이다. 최근 저자 등이 개발한 자가포식 활성화 성분인 AQUATIDE™는 피부 세포에서 sirtuin 단백질과 결합하여 자가포식 기전을 활성화하는 것으로 밝혀진 바 있다 (Lim et al., 2017). 펩타이드 유도체인 AQUATIDE™는 자가포식을 활성화하는 효과 외에도 산화 스트레스에 의한 세포의 손상을 강력하게 억제하는 것으로 나타난 바 있으며, 이러한 효과는 AQUATIDE™ 자체가 항산화 효과를 가지고 있는 것 외에도 세포 내에서 peroxiredoxin, heat shock protein 70, heat shock protein 90 등과 같은 다양한 항산화 물질의 발현을 촉진하기 때문인 것으로 파악된다. 이러한 항산화 효과는 임상적으로 피부에서 탄화 단백질의 감소와 탄력 증가 등의 효과를 나타내는 것으로 확인된 바 있다(Lim et al., 2018). 앞으로도 자가포식 기전에 대한 체계적인 연구를 통해 산화 스트레스를 효과적으로 제어할 수 있는 다양한 원료과 기술을 개발할 수 있을 것으로 예상되며, 새로운 화장품으로서 주름을 개선하거나 색소 침착을 개선하는 등의 효과를 기대할 수 있으리라 생각된다.
참고문헌
Gašperlin, M., & Gosenca, M. (2011). Main approaches for delivering antioxidant vitamins through the skin to prevent skin ageing. Expert Opinion on Drug Delivery, 8(7), 905-919.
Höhn, A., Sittig, A., Jung, T., Grimm, S., & Grune, T. (2012). Lipofuscin is formed independently of macroautophagy and lysosomal activity in stress-induced prematurely senescent human fibroblasts. Free Radic Biol Med, 53(9), 1760-1769.
Kim, K. E., Cho, D., & Park, H. J. (2016). Air pollution and skin diseases: Adverse effects of airborne particulate matter on various skin diseases. Life Sci, 152, 126-134.
Lee, J., Giordano, S., & Zhang, J. (2012). Autophagy, mitochondria and oxidative stress: cross-talk and redox signalling. Biochem J, 441(2), 523-540.
Li, L., Tan, J., Miao, Y., Lei, P., & Zhang, Q. (2015). ROS and Autophagy: Interactions and Molecular Regulatory Mechanisms. Cellular and Molecular Neurobiology, 35(5), 615-621.
Lim, C. J., Lee, Y. M., Kang, S. G., Lim, H. W., Shin, K. O., Jeong, S. K. et al. (2017). Aquatide Activation of SIRT1 Reduces Cellular Senescence through a SIRT1-FOXO1-Autophagy Axis. Biomol Ther (Seoul), 25(5), 511-518.
Lim, J., Lim, C. J., Kim, S., Nam, G., Chang, M., Park, K. et al. (2018). Antiaging and antioxidant effects of topical autophagy activator: A randomized, placebo-controlled, double-blinded study. J Cosmet Dermatol.
Mamalis, A., Koo, E., & Jagdeo, J. (2016). Resveratrol
Prevents Reactive Oxygen Species–Induced Effects of Light-Emitting Diode–Generated Blue Light in Human Skin Fibroblasts. Dermatologic Surgery, 42(6), 727-732.
Miwa, S, Muller, F. L. & Beckman K. B. (2008) The Basics of Oxidative Biochemistry. In S. Miwa, K. B. Beckman and F. L. Muller. (Eds.) Oxidative Stress in Aging. (11-38). Towata, NJ: Humana Press
Poljsak, B., Dahmane, R., & Godic, A. (2013). Skin and antioxidants. J Cosmet Laser Ther, 15(2), 107-113.
Rinnerthaler, M., Bischof, J., Streubel, M. K., Trost, A., & Richter, K. (2015). Oxidative stress in aging human skin. Biomolecules, 5(2), 545-589.
Vierkötter, A., Schikowski, T., Ranft, U., Sugiri, D., Matsui, M., Krämer, U. et al. (2010). Airborne Particle Exposure and Extrinsic Skin Aging. Journal of Investigative Dermatology, 130(12), 2719-2726.
Yang, H.-Y., & Lee, T.-H. (2015). Antioxidant enzymes as redox-based biomarkers: a brief review. BMB Reports, 48(4), 200-208.
Young, A. R. J., & Narita, M. (2010). Connecting autophagy to senescence in pathophysiology. Current Opinion in Cell Biology, 22(2), 234-240.